Les Staphylocoques ont été découverts dans un pus par Pasteur en 1880. En 1883, Ogston a créé le nom de « Staphylocoque » pour décrire ces grains (kokkos) groupés en amas irréguliers à la façon d’une grappe de raisin (staphylos). En 1884, Rosenbach a obtenu des cultures pures de ces bactéries.
Il a scindé le genre Staphylococcus en deux groupes selon que les colonies étaient blanches ou dorées.
1 – CARACTÈRES GÉNÉRAUX DES STAPHYLOCOQUES :
A – Position taxonomique et classification :

La famille des Micrococcaceae est composée de trois genres de cocci à Grani positif en amas qui diffèrent par leur G + C % : Staphylococcus (30 – 39 %), Micrococcus (65 – 75 %) et Planococcus (48 – 52 %). Ce dernier genre n’est rencontré qu’en bactériologie marine.
Les espèces appartenant à ces trois genres possèdent une catalase et se développent en aérobiose. Les cocci à Gram positif en amas qui se développent uniquement en anaérobiose sont dénommés Peptococcus et seront traités avec les bactéries anaérobies.
Le genre Staphylococcus occupe une place très importante en pathologie humaine et animale. Le genre Micrococcus a un pouvoir pathogène pratiquement nul.
Néanmoins des souches de microcoques sont fréquemment isolées en bactériologie médicale. Il s’agit alors de contaminants qu’il faut distinguer des staphylocoques. Les caractères qui permettent de distinguer les genres Staphylococcus et Micrococcus sont indiqués dans le tableau I.

-() espèces ou souches présentant un caractère différent
a : S. hominis est aérobie strict et S. saccharotyticus anaérobie strict
b ; Micrococcus kristinae et M. varions peuvent croître en anaérobiose
c : M. kristinae, M. varions peuvent fermenter le glucose
d : S. sciuri, S. lentus, S. caseolyticus ont une cytochrome c oxydase
Au sein du genre Staphylococcus, on distingue d’après la classification de Kloos et Schleifer plus de 20 espèces. Un certain nombre d’entre elles sont trouvées chez l’homme, d’autres sont présentes chez les animaux ou dans les aliments (viandes, produits laitiers…). Parmi les espèces retrouvées chez l’homme :
– trois espèces occupent une place privilégiée : 5. aureus, S. epidermidis et
S. saprophyticus,
– les autres, plus rarement impliquées en pathologie humaine, sont : S. hominis,
S. haemolyticus, S. warneri, S. capitis, S. saccharolyticus, S. auricularis,
S. simulons, S.cohnii, S.xylosus, S. intermedius, S. lugdunensis et S . schleiferi.
Il est classique d’opposer S. aureus qui produit une coagulase et est souvent pathogène, aux autres staphylocoques, non producteurs de coagulase et plus rarement responsables d’infections.

B – Habitat et épidémiologie :
II s’agit de germes très répandus dans la nature (air, eau, sol). Les staphylocoques, en particulier les espèces S. aureus et S. epidermidis, font partie de la flore normale de nombreux individus qui sont des « porteurs asymptomatiques ». Cependant ces souches peuvent être à l’origine d’auto-infections ou contaminer d’autres individus.
On peut estimer que 20 à 75 % des sujets sont porteurs de S. aureus : porteurs persistants, porteurs occasionnels, ou transitoires ; à l’opposé, certains individus sont « non porteurs ».
Les staphylocoques peuvent être trouvés particulièrement dans les fosses nasales antérieures (S. aureus : 30 – 40 %, S. epidermidis 30 – 100 %). On peut également les isoler de la peau (S. epidermidis 85 – 100 %) et surtout des zones chaudes et humides de celle-ci (creux axillaire, périnée) où l’on peut également trouver S. aureus. n n’est pas rare d’isoler S. aureus des selles.
La transmission est surtout interhumaine directe (contact, dissémination manuportée, à partir du nez notamment) ou indirecte par l’intermédiaire des aliments ou du milieu extérieur.
Le nouveau-né est rapidement colonisé par S. aureus après l’accouchement et, plus tard, l’enfant peut être contaminé au sein d’une collectivité ; la contamination interhumaine est très variable, certains individus étant de « dangereux disséminateurs », alors que d’autres sujets ne transmettent pratiquement jamais leurs souches.
II – STAPHYLOCOCCUS AUREUS :
A – Pouvoir pathogène :
1. Pouvoir pathogène naturel :
Les infections à S. aureus sont très fréquentes et apparaissent sous des aspects cliniques très variés.
a/ Les staphylococcies cutanées, sous-cutanées et muqueuses :
– S. aureus peut être à l’origine d’infections cutanées superficielles ou profondes.
L’infection superficielle se traduit par un impétigo, un onyxis ou une folliculite.
L’infection profonde est représentée par des abcès intrafolliculaires de toute la gaine du poil appelés furoncles, ou par des infections des canaux des glandes sudoripares appelées hidrosadénites. L’anthrax est un conglomérat de furoncles et la staphylococcie maligne de la face en est une localisation particulièrement grave.
Furonculose et hidrosadénite peuvent être récidivantes. Ces récidives sont parfois liées à des facteurs déclenchants : diabète, surmenage…
On observe aussi des infections cutanées associées à la présence de cathéters ainsi que des psoriasis ou des eczémas surinfectés par S. aureus, mais sans signes cliniques d’infection.
– Des rashes scarlatiniformes font partie du syndrome de choc toxique lié à la présence de souches productrices de la toxine du syndrome de choc toxique ou de certaines entérotoxines. Des rashes sont aussi liés à la présence de toxine pyrogène.
– Le syndrome de Lyell staphylococcique ou Maladie de Ritter von Rittershain ou syndrome des enfants ébouillantés est lié à la sécrétion d’une toxine staphylococcique, l’exfoliatine ou épidermolysine, qui provoque la desquamation de la couche superficielle de l’épidémie.
– Au niveau des muqueuses, S. aureus peut être impliqué dans des phlegmons de l’amygdale, des sinusites ou des otites parfois récidivantes.
b/ Localisations viscérales à S. aureus :
Elles surviennent soit isolément, soit dans le cadre d’une septicémie patente :
– staphylococcies osseuses : l’ostéomyélite aiguë est une affection de l’enfant ou de l’adolescent : elle touche classiquement les os longs et peut devenir chronique.
Les infections osseuses staphylococciques post-chirurgicales sont très préoccupantes.
– staphylococcies pleuropulmonaires : les formes du nourrisson sont très fréquentes et graves. Les formes de l’adulte sont plus rares et peuvent apparaître après une virose telle la grippe.
– staphylococcies urogénitales : les pyélonéphrites à staphylocoques sont assez fréquentes ; S. aureus peut aussi entraîner la formation d’abcès isolés du rein ou des phlegmons périnéphrétiques.
– staphylococcies neuroméningées : elles sont rares et dominées par les méningites observées surtout en milieu neuro-chirurgical (valves). S. epidermidis est alors souvent isolé. Les méningites ne doivent pas être confondues avec l’épidurite staphylococcique, le pus étant alors localisé dans l’espace péridural.
Des abcès du cerveau peuvent être rencontrés.
– l’endocardite staphylococcique s’observe notamment chez les patients porteurs de valves cardiaques artificielles. Chez les drogués, ce sont souvent des endocardites du coeur droit.
c/ Septicémies à S. aureus :
Les staphylococcémies sont causées et entretenues par un foyer infectieux primaire compliqué de thrombophlébite ; ce sont des infections fréquentes, d’une gravité préoccupante. L’évolution est émaillée de métastases septiques.

d/ Toxi-infections alimentaires :
– Elles sont dues à l’ingestion d’entérotoxines (A et E), préformées dans l’aliment, résistant aux sucs digestifs et pour certaines à la chaleur, entraînant des troubles d’apparition précoce (moins de 3 heures) avec vomissements, diarrhée, déshydratation et absence de fièvre.
– L’évolution est bénigne, sauf en cas de pertes hydro-électrolytiques importantes (sujets âgés, nourrissons).
– Le staphylocoque doit être recherché dans l’aliment.
– La recherche de l’entérotoxine contenue dans les aliments ou produite par la souche isolée est possible dans des laboratoires spécialisés.
et Entérocolites aiguës :
– Elles surviennent au décours d’une antibiothérapie et sont dues à la prolifération de S. aureus antibiorésistant et producteur d’entérotoxine.
– Ces staphylocoques doivent être recherchés dans les selles.
– Les laboratoires spécialisés peuvent déceler si les staphylocoques isolés sont producteurs ou non d’entérotoxine.
// Syndrome de choc toxique (TSS)
II associe fièvre, hypotension, rash maculaire érythémateux suivi d’une desquamation scarlatiniforme et souvent de diarrhée. Les hémocultures sont stériles.
Il est lié à l’action de la toxine staphylococcique, TSST-1 (Toxic Shock Syndrome Toxin-1), ou, semble-t-il, de certains sérotypes d’entérotoxine.
Ce syndrome a été décrit en 1978 aux ILS.A. comme la conséquence d’une prolifération vaginale de S. aureus chez des femmes utilisant des tampons périodiques. Des souches responsables de TSS peuvent être également isolées de lésions diverses.
La grande fréquence des TSS aux U.S.A. entre 1978 et 1982 n’a pas été observée en Europe.
2. Pouvoir pathogène expérimental :
II est nécessaire d’injecter 5.106 UFC de S. aureus sous la peau pour produire une infection en peau saine chez l’homme ; par contre 100 bactéries suffisent sur une zone de suture ou sur une peau comportant des lésions préexistantes.
Aucun animal de laboratoire n’est capable de reproduire les différents aspects de la maladie humaine. Cependant le lapin est l’animal le plus sensible : l’injection sous-cutanée de S. aureus produit un abcès qui guérit spontanément et l’injection intraveineuse conduit à la mort en 4 à 10 jours avec des abcès viscéraux (reins surtout).
B – Physiopathologie :
S. aureus peut devenir pathogène à la suite de diverses circonstances :
– pénétration du germe dans l’organisme, le plus souvent après rupture de la barrière cutanée (blessures, interventions chirurgicales, brûlures, dermatoses, injections, cathéters,…) ou au niveau d’un follicule pileux.
– rupture de l’équilibre hôte-bactérie à la suite de circonstances favorisant l’infection : virose (grippe, rougeole), antibiothérapie sélectionnant une souche de S.aureus, déficits immunitaires, diabète, alcoolisme…
Il s’ensuit une multiplication bactérienne avec production d’enzymes et de toxines correspondant à l’expression de la virulence du germe. Ceci explique l’extension de l’infection qui peut aboutir à une septicémie. Schématiquement, plusieurs étapes peuvent se succéder dans lesquelles sont impliquées diverses substances d’origine staphylococcique :
– envahissement local : hyaluronidase, exfoliatine,
– nécrose cellulaire : protéases, lipases, estérases, DNases, phosphatases, toxine alpha (et bêta, gamma, delta),
– diminution des défenses locales : leucocidine, capsule, protéine A,
– foyer de thrombophlébite régionale : coagulase,
– embols septiques : fibrinolysine.
En raison de ses nombreuses toxines et enzymes, S. aureus détruit les cellules de l’organisme et produit du pus. Il est ainsi le type même du germe pyogène.
C – Substances excrétées par S. aureus :
Elles sont particulièrement nombreuses chez S. aureus.
Les déterminants génétiques sont connus pour la plupart de ces substances (Tableau II).
1. Toxines de S. aureus :
– les hémolysines : leurs principales propriétés sont regroupées dans le tableau III :
– l’alpha-hémolysine ou alpha-toxine staphylococcique est de nature protéique, thermostable, antigénique, induisant la formation d’anticorps neutralisants.
Elle est cytotoxique et cytolytique pour une grande variété de types cellulaires.
Elle semble s’insérer dans la membrane cytoplasmique des cellules-cibles et permet le passage de molécules de petite taille.
– la bêta-hémolysine est thermolabile. Elle agit comme une sphingomyélinase de type C et donne une hémolyse accrue en présence de souches de Streptococcus agalactiae : c’est le CAMP-test (du nom de leurs découvreurs : Christie, Atkins, Munsch-Petersen)
– la gamma-hémolysine comporte deux facteurs 1 et II agissant en synergie.


Ceux-ci sont antigéniques et le cholestérol inhibe leur action. Le mode d’action moléculaire de cette toxine reste inconnu.
– la delta-hémolysine contient des acides aminés hydrophobes et hydrophiles et agit comme un détergent sur les membranes.
la leucocidine de Panton Valentine détruit très spécifiquement les polynucléaires et les macrophages de l’homme et du lapin. La leucocidine purifiée, provoque une dermonécrose chez le lapin. L’effet toxique sur les leucocytes serait dû à une modification de la perméabilité cationique. On distingue 2 constituants F et S agissant en synergie.
– les entérotoxines : elles sont responsables d’intoxications alimentaires et sont caractérisées par leur masse moléculaire comprise entre 27 800 et 34 100 daltons, leur point iso-électrique et leur sérotypie.
Elles sont au nombre de 7 : A, B, D et E.
Les sérotypes A, B et D sont les plus fréquents dans les intoxications alimentaires.
Certaines de ces entérotoxines ont un effet mitogène sur les lymphocytes T.
Certaines (Ent B) sont des protéines plus thermostables que les autres. Elles résistent aux enzymes protéolytiques.
La dose minimale toxique se situe aux environs de 1 (lg pour 100 g d’aliments. La détection des toxines dans les aliments, les matières fécales ou les bouillons de culture s’effectue par une technique immunologique'(immunodiffusion, agglutination, radio-immunologie, ELISA).
La possession d’un gène d’entérotoxine n’est pas exceptionnelle. On retrouve une ou plusieurs de ces toxines chez environ la moitié des souches hospitalières, ce qui rend délicat le rattachement d’un syndrome clinique à l’isolement d’une souche entérotoxinogène.
– les toxines épidermolytiques (ou exfoliatines) sont produites par certaines souches de S. aureus (5 %).
Ce sont des protéines d’un poids moléculaire de 27 000 daltons et antigéniques ; 30 à 40 % des souches du groupe phagique II produisent ces toxines, soit 5 % des souches hospitalières.
On distingue 2 sérotypes A et B : le gène codant le sérotype A est chromosomique (90 % des exfoliatines) et celui codant le sérotype B est plasmidique (4 à 5 % des exfoliatines). Les 2 sérotypes peuvent être produits par une même souche.
Ces toxines (A ou B) entraînent un clivage intra-épidermique. Le mode d’action au niveau moléculaire reste inconnu. Ces toxines peuvent être mises en évidence sur le souriceau nouveau-né, par contre-immunoélectrophorèse ou ELISA. Les souches toxinogènes sont particulièrement responsables d’infections néonatales et infantiles : syndrome de Lyell, impétigo bulleux staphylococcique…
– les toxines pyrogènes. Il existe deux toxines pyrogènes, mitogènes, aspécifiques et antigéniques d’un poids moléculaire de 12000 daltons réparties en deux sérotypes A et B. L’effet pyrogène est observé sur le lapin. Ces toxines sont impliquées dans les fièvres scarlatiniformes staphylococciques.
– toxine du syndrome de choc toxique (TSST). Au cours de ce syndrome on observe notamment un rash érythémateux avec ou sans desquamation. Les staphylocoques responsables produisent une toxine (TSST-1) sensible aux enzymes protéolytiques, antigénique et d’une masse moléculaire de 20 000 daltons ; ce syndrome a également été associé à la production d’entérotoxines ; cette toxine est produite par 90 % des souches isolées dans les syndromes de choc toxique et par 11 % des souches hospitalières tout-venant.
– « Succinic oxidase factor ». Cette toxine inhibe l’oxydation du succinate par les mitochondries isolées du foie de souris.
2. Enzymes de S. aureus :
Ces enzymes ont un intérêt pathogénique et/ou diagnostique important.
a/ Coagulase libre :
S. aureus est capable d’excréter une protéine provoquant la coagulation du plasma humain ou de lapin (prélevé sur citrate, oxalate, héparine ou EDTA) et appelée « coagulase libre ». Un staphylocoque produisant cette toxine sera identifié comme S. aureus. Mais 2 espèces observées en pratique vétérinaire peuvent produire cette enzyme : S. intermedius et S. hyicus.
La formation du coagulum ne nécessite pas la présence de calcium, elle n’est pas activée par le fibrinogène purifié, mais a besoin d’une globuline voisine de la prothrombine (coagulase-reacting-factor). Cette coagulase est antigénique (7 groupes antigéniques) et entraîne l’apparition d’anticorps inhibant l’activité biologique.
Elle joue un rôle dans la formation de thrombophlébites suppurées et inhiberait la phagocytose.
Au laboratoire, la détection de la coagulase s’effectue en mettant en présence du plasma de lapin et la souche à étudier dans un tube à 37°C ; la prise en masse du mélange est réalisée en 3 à 6 ou parfois en 24 heures ; la coagulation peut être suivie d’une dissolution du caillot par suite de l’action de la staphylokinase.
b/ Coagulase liée ou dumping factor ou facteur d’affinité pour le fibrinogène :
A côté de cette coagulase « libre », on reconnaît une coagulase insoluble, « liée » à la surface des germes et également appelée dumping factor. Elle se lie au fibrinogène et est responsable de l’agrégation sur lame des staphylocoques en présence de sérum ; ce facteur d’affinité pour le fibrinogène peut être mis en évidence par contact de la souche à étudier avec des hématies de mouton ou des particules de latex recouvertes de fibrinogène ; une agglutination en quelques secondes est trouvée chez 98 % des souches de S. aureus. Ce dumping factor ne dégrade pas le fibrinogène en fibrine. Cependant, ce test peut être positif pour certaines espèces de staphylocoques coagulase négatifs, telles S. lugdunensis et S. schleiferi.
c/ Fibrinolysine ou staphylokinase :
Cette enzyme est un activateur du plasminogène (action semblable à celle de la streptokinase), agissant sur le plasma humain et de lapin. Cette activité est mise en évidence sur des plaques de gélose contenant de la fibrine (zone d’éclaircissement).
Cette substance thermolabile est antigénique. Elle dissout les caillots et pourrait jouer un rôle dans la formation d’embols septiques.
d/ Hyaluronidase :
Cette enzyme thermolabile hydrolyse l’acide hyaluronique, elle fluidifie la substance fondamentale du tissu conjonctifet peut être recherchée par viscosimétrie.
e/ Nucléase :
La nucléase (DNase) de S.aureus (ou thermonucléase) est thermostable, alors que celle des autres espèces bactériennes est thermolabile.
L’activité enzymatique est mise en évidence sur milieu à base d’ADN avec du bleu de toluidine (halo rosé) ; la reaction peut être rendue plus spécifique par séro-inhibition de la nucléase de S. aureus, recherche qui peut être pratiquée en 4 heures.
// Autres activités enzymatiques
Des activités lipasiques, estérasiques, protéasiques peuvent être mises en évidence (milieu à l’oeuf de Baird-Parker), de même qu’une activité phosphatasique ; ainsi il existe 2 phosphatases (acide et alcaline) qu’il est facile de rechercher.
D – Structure et antigènes :
Plusieurs substances de la paroi des staphylocoques jouent un rôle dans les réactions immunologiques.
1. Le peptidoglycane :
Staphylocoques et microcoques possèdent des peptidoglycanes qui diffèrent entre eux par leurs acides aminés. La structure du peptidoglycane de S. aureus est bien connue : le diaminoacide présent est la L-lysine.
Les staphylocoques sont lysés par une endopeptidase, la lysostaphine, qui clive la liaison glycyl-glycine présente dans le pont interpeptidique, mais ils résistent généralement à l’action muramidasique du lysozyme.
2. Les acides teichoïques :
La paroi des staphylocoques comporte des polyolphosphates (polyribitol ou polyglycérol-phosphate) substitués par des hexoses.
Les microcoques contiennent des acides teichoïques sans ribitol ou glycerol.
Les acides teichoïques de S. aureus sont aussi appelés polysaccharide pA. Dans certaines conditions les acides teichoïques peuvent être remplacés par des acides teichuroniques (N-acétyl D-fucosamine, acide N-acétyl D-mannosaminuronique en polymères chez S. aureus). Les acides teichoïques jouent un grand rôle sur les interactions entre bactéries et cellules et sur fixation des bactériophages ; de plus ils sont antigéniques. Ils sont liés de façon covalente aux chaînes de peptidoglycane.
3. Polysaccharides de surface :
Ces antigènes de surface ont été décrits chez des souches capsulées. Cette capsule peut se former de façon plus abondante lors de la croissance de S. aureus en présence de sérum dans un milieu faiblement gélose. Ces antigènes sont aussi décelables sur bon nombre de souches dites non capsulées, mais porteuses de polysaccharides identiques en moindre quantité. Certains de ces polyosides empêchent l’activation de la voie alterne du complément et protègent ainsi la bactérie de la phagocytose et de l’action bactéricide du sérum. Une classification de ces polysaccharides en 8 types capsulaires a été proposée et deux types, 5 et 8, recouvrent 70-80 % des souches responsables de septicémies ; ces travaux peuvent déboucher sur la détection d’antigènes solubles staphylococciques.

4. Protéine A :
II s’agit d’une protéine (PM 42 kDa) antigénique, insoluble à l’état natif et constitutive de la paroi de S. aureus. Elle fixe (schéma 3) la fraction Fc des immunoglobulines humaines IgGl, 2 et 4, laissant la partie Fab libre. In vitro, on peut ainsi aisément fixer à la surface de S. aureus des immunoglobulines (par ex. anti-méningocoque ou anti-pneumocoque) pour détecter les antigènes correspondants dans les cultures ou les produits pathologiques ; il s’agit de la coagglutination.
N.B. : la fixation des IgG sur la protéine A est fonction de l’espèce animale d’où proviennent les IgG et aussi des sous-classes d’IgG considérées : par exemple, les IgG de mouton ou de chèvre se fixent peu sur la protéine A.
5. Antigènes de type et sérotypie :
Toutes les souches de S. aureus possèdent des facteurs antigéniques de surface utilisés dans des classifications. Il existe près de 30 facteurs antigéniques et deux classifications principales.
Dans le système de Pillet, 13 sérums sont utilisés ; les sérotypes les plus fréquents sont les I, II, III et 18 ; en France 10 % des souches sont non typables dans ce système.
Le système d’Oeding permet une meilleure approche de la structure antigénique (mosaïque) des souches, mais est de réalisation technique plus difficile ; les antigènes sont désignés par les sigles a4, a5, bl, cl,hl…
6. La lysotypie :
Cette méthode est utilisée pour comparer les souches de S. aureus isolées au cours d’épidémies hospitalières. Elle consiste à soumettre la souche à tester à une série de 23 bactériophages. La lyse de la souche par un bactériophage est conditionnée par l’existence au niveau de la paroi d’un récepteur spécifique pour ce phage. Certaines combinaisons lytiques ont lieu plus fréquemment que d’autres, ce qui a permis de définir des groupes phagiques : groupes I, II, III, IV (non observé chez l’homme) et V.
Les groupes 1 et III sont les plus fréquents chez l’homme.
E – Diagnostic bactériologique d’une infection à S. aureus :
1. Les prélèvements :
Ils doivent être effectués avant toute antibiothérapie et pratiqués avec une asepsie rigoureuse : non seulement pour les hémocultures, les LCR, les urines, mais aussi pour les pus, les biopsies, les aspirations bronchiques, les écouvillonnages. Il faut éviter la contamination du produit pathologique par des souches de Staphylococcus aureus et de S. epidermidis souvent présentes sur la peau. La répétition des hémocultures permet de trancher en faveur d’une septicémie ou de souillures.
Les bactériologistes peuvent aussi être amenés à rechercher et à dénombrer les staphylocoques dans les aliments, les eaux, ou dans l’air en milieu hospitalier.
2. Examen direct :
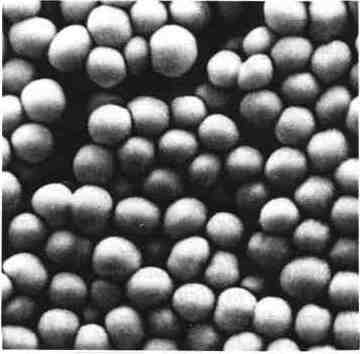
Les staphylocoques sont des cocci à Gram positif, de 0,8 à 1 u.m de diamètre, disposés en amas, en diplocoques, en courtes chaînettes, voire en grappes typiques. Ils sont immobiles, asporulés, parfois capsulés.
L’observation de cocci à Gram positif en courtes chaînettes ou en amas dans un pus permet souvent d’évoquer un staphylocoque.
3. Caractères culturaux :
S. aureus croît abondamment sur milieu gélose (colonies de 1 à 2 mm de diamètre) ; certaines souches produisent un pigment jaune-orange, mais cette production est irrégulière.
La culture est obtenue en 18 à 24 heures à 37°C (culture possible de 10 à 45°C) sur milieux ordinaires. S. aureus pousse en présence de fortes concentrations salines (milieu sélectif de Chapman à 7,5 % de NaCl). Le pH optimal est de 7,0 à 7,5.
Il existe, des variants exigeants en facteurs de croissance : thiamine, acide panthoténique…
Pour les produits monomicrobiens, l’isolement est facile en bouillon, ou en milieu solide non sélectif (trypticase-soja, Mueller-Hinton, gélose au sang).
Pour les produits pathologiques polymicrobiens ou les aliments, on doit recourir à des milieux sélectifs comme le milieu de Chapman (milieu hypersalé + mannitol) ou milieu de Baird-Parker au tellurite (utilisé surtout en microbiologie alimentaire).
4. Type respiratoire :
S. aureus est un germe aérobie-anaérobie facultatif.
Quelques souches exigent du CO2 pour croître. Toutes les souches produisent une catalase.
5. Identification :
En 18 à 24 heures sur milieu gélose riche, on observe des colonies de 1 à 2 mm de diamètre produisant parfois un pigment jaune et constituées de cocci à Gram (+) en amas, catalase (+).
Sur milieu de Chapman, S. aureus provoque une acidification (virage au jaune) du mannitol ; sur milieu de Baird-Parker, 5. aureus forme des colonies noires (réduction du tellurite) avec un halo clair (protéolyse) et, plus tardivement, une opacification dans le halo (lipase).
Sur les colonies suspectes, on recherchera la classique coagulase ou une inhibition de la nucléase thermostable à l’aide d’anticorps. Des tests de dépistage rapide existent également (recherche du facteur d’affinité pour le fibrinogène et recherche de protéine A). Mais il existe quelques faux positifs et faux négatifs avec ces tests.
S’il s’agit de l’espèce S. aureus, l’identification est parfois complétée dans une perspective épidémiologique par des galeries plus poussées, par la sérotypie ou par la lysotypie.
A noter :
– que l’isolement de certaines souches de S. aureus, à partir d’hémocultures notamment, peut parfois être difficile (endocardite, suppurations chroniques), car certaines souches donnent des microcolonies d’apparition lente dont la croissance peut être améliorée par l’addition de facteurs de croissance.
– que la recherche de toxines : entérotoxines, exfoliatine est réservée à ce jour à des laboratoires spécialisés, mais que des recherches d’entérotoxines par des techniques d’agglutination passive de particules de latex ou par ELISA, directement dans les produits sont maintenant utilisées, notamment en bactériologie alimentaire.
– que le terme de staphylocoque pathogène (tout comme celui de staphylocoque doré) doit être proscrit : S. aureus isolé de la peau ou des muqueuses (portage) n’est pas pathogène, alors que S. epidermidis peut, dans certaines circonstances, être pathogène.
6. Diagnostic différentiel :
– Micrococcus. Ce germe est séparé des staphylocoques par son type respiratoire, par son incapacité à oxyder le glycérol (1 %) en présence d’érythromycine (0,4 (ig/ml) et par sa résistance à 200 u.g/ml de lysostaphine (voir Tableau I).
– Autres espèces de staphylocoques : il faut noter que certaines souches de S. aureus peuvent ne pas produire de coagulase libre en raison d’une mutation.
Chez d’autres souches de S. aureus, le facteur d’affinité pour le fibrinogène peut être masqué par la présence d’une capsule polysaccharidique.
Des espèces de staphylocoques autres que 5. aureus peuvent être pigmentées particulièrement à la primoculture : S. saprophyticus, S. hominis, S. haemolyticus…
D’autres espèces peuvent aussi être hémolytiques (S. haemolyticus, S. warneri, S. schleiferi…)
Enfin des espèces autres que S. aureus peuvent pousser sur milieu de Chapman et acidifier le mannitol (S. cohnii, S. saprophyticus,…).
– Stomatococcus. Ce germe, catalase négative ou faible, ne croît pas sur milieu hypersalé, n’est pas hémolytique et ses colonies de consistance élastique adhèrent à la gélose.
7. Diagnostic rapide :
II n’existe pas actuellement de diagnostic rapide et fiable d’infection à S. aureus par recherche d’antigènes solubles. Les meilleurs antigènes candidats pour ce type de dépistage seraient représentés par les polysaccharides de surface des staphylocoques.
8. Diagnostic indirect :
II a actuellement peu de valeur pratique.
Le titrage des antistaphylolysines alpha peut présenter un intérêt dans des infections profondes ou chroniques (osseuses notamment), le taux normal étant inférieur ou égal à 2 UI par ml. La valeur de cette réaction sérologique est actuellement contestée.
La recherche d’anticorps anti-acides teichoïques ou anti-peptidoglycane par contre-immuno- électrophorèse ou diffusion en gel peut avoir des indications en cas d’endocardites ou de complications métastatiques à hémocultures négatives ou de foyers infectieux inaccessibles à la culture, mais on ne dispose pas à ce jour d’antigène bien standardisé.
III – STAPHYLOCOQUES COAGULASE NÉGATIFS :
A – Identification :
Les staphylocoques coagulase négatifs ne sont identifiés complètement que lorsque les circonstances de leur isolement indiquent qu’ils sont potentiellement en situation de jouer un rôle de pathogène. Les tableaux IV et V indiquent les caractères bactériologiques qui permettent de faire le diagnostic d’espèce.

A propos de la croissance en anaérobiose, de l’hémolyse et du test à la novobiocine, trois remarques doivent être faites.
1. Étude de la croissance en anaérobiose (inoculation par 0,5 ml de bouillon à 0,5 unité Me Farland) :
S. hominis ne pousse quasiment qu’en aérobiose (bouillon thioglycolate).
S. saccharolyticus ne pousse qu’en anaérobiose.
S. haemolyticus et S. capitis croissent beaucoup mieux en aérobiose qu’en anaérobiose.
2. Étude de la vitesse d’apparition de l’hémolyse :
L’hémolyse de S. haemolyticus est tardive (après plus de 24 heures d’étuve souvent).
3. Test à la novobiocine :
S. saprophyticus est résistant à cet antibiotique. Ce test est utile sur des souches isolées d’urines. Mais d’autres staphylocoques peuvent résister aussi à la novobiocine (S. cohnii, S. xylosus).
En pratique, S. hominis, S. haemolyticus et S. simulons représentent 5 à 20 % des staphylocoques coagulase-négatifs isolés chez l’homme.
B – Signification clinique des staphylocoques coagulase-négatifs :
Certaines espèces (S. epidermidis, S. hominis, S. saccharolyticus, S. capitis et S. auricularis) sont trouvées de façon constante sur la peau ou les muqueuses des orifices naturels.
Les autres espèces y sont rencontrées de façon inconstante et la densité de ces populations bactériennes est souvent faible. Il existe une adaptation écologique de S. capitis au cuir chevelu et de S. auricularis au conduit auditif externe.


Les staphylocoques coagulase négatifs ont longtemps été considérés comme dépourvus de pouvoir pathogène et comme de simples contaminants de prélèvements défectueux. Aujourd’hui il est clair qu’au moins deux espèces, S. epidermidis et S. saprophyticus, sont des bactéries opportunistes potentiellement pathogènes.
Les principales infections dues à des staphylocoques coagulase négatifs, ainsi que leur place en pathologie sont indiquées dans les tableaux VI et VIL
1. S. epidermidis :
II peut être responsable d’infections de prothèses vasculaires ou articulaires, de valves cardiaques, de valves de dérivations du LCR. Il est également impliqué dans la survenue de péritonites consécutives à des dialyses péritonéales, d’endocardites subaiguës chez les drogués, d’endophtalmies et d’infections diverses particulièrement chez les immunodéprimés. L’aptitude de cette espèce à coloniser la surface des polymères (cathéters, prothèses), et les cellules serait liée à l’abondante capsule polysaccharidique produite par ce germe.
2. S. saprophyticus :
Cette espèce a un nom particulièrement mal choisi puisqu’elle peut être responsable d’infections urinaires qui ont la particularité de s’observer chez des jeunes femmes habituellement non hospitalisées. Cette espèce serait responsable de 5 à 10 % des infections urinaires en raison de son aptitude à adhérer à l’épithélium urinaire.
3. Les autres espèces :
Elles ont un pouvoir pathogène très occasionnel ou même discutable. Pour affirmer leur rôle dans une infection, il est nécessaire d’isoler la souche à plusieurs reprises en l’absence d’une autre espèce bactérienne potentiellement pathogène.
C – Facteurs toxiques élaborés par les staphylocoques coagulase – négatifs :
Ces staphylocoques peuvent élaborer des hémolysines de type delta, et parfois une coagulase liée, une fibrinolysine, une leucocidine, une DNase. Pratiquement, les souches isolées d’infections (plaies, hémocultures, abcès) produisent plus fréquemment un ou plusieurs de ces facteurs de virulence que les souches isolées de sujets sains.
IV – TRAITEMENT ET PROPHYLAXIE DES INFECTIONS À STAPHYLOCOQUES :
A – Traitement antibiotique :
Les antibiotiques ont modifié le pronostic des infections graves comme la staphylococcie maligne de la face. Les infections systémiques à staphylocoques, que ce soit à S. aureus ou à S. epidermidis, doivent être traitées par une antibiothérapie bactéricide. Cette bactéricidie est généralement obtenue en associant une pénicilline du groupe M à un antibiotique d’une autre famille. La résistance d’une souche à toutes les bêta-lactamines justifie l’emploi d’un antibiotique comme la vancomycine ou la teicoplanine qui sont constamment actifs, mais sont aussi plus lentement bactéricides et plus coûteux.
1. Le problème des bêta-lactamines :
al La sécrétion de pénicillinases :
— Description du phénomène
Aujourd’hui près de 90 % des souches de staphylocoques isolées en milieu hospitalier et en milieu extra-hospitalier résistent à la pénicilline G par production de pénicillinases qui ouvrent le cycle bêta-lactame de la molécule et inactivent l’antibiotique. Ces pénicillinases sont extra-cellulaires, inductibles et généralement codées par des plasmides.
Elles inactivent les pénicillines G et V, les aminopénicillines, les carboxypénicillines et les uréidopénicillines.
Par contre elles ont peu d’affinité pour la méticilline, l’oxacilline, la cloxacilline et toutes les céphalosporines qui restent actives sur ces souches productrices de pénicillinases. Ces pénicillinases sont inhibées par l’acide clavulanique.
— Détection de la résistance enzymatique
La production de pénicillinase est détectée en observant sur l’antibiogramme standard la zone d’inhibition autour d’un disque de pénicilline G. Elle se traduit par une diminution du diamètre d’inhibition par rapport à une souche sensible, non productrice de pénicillinase. Une souche sensible présente un grand diamètre d’inhibition avec une bordure floue, appelée zone fantôme, qui correspond à une lyse des bactéries. Une souche résistante par production de pénicillinases donne une zone d’inhibition plus petite à bord net. A la périphérie de cette zone d’inhibition se trouvent des colonies bien développées appelées « colonies squatters ».
En pratique le disque de pénicilline G est suffisant sur l’antibiogramme pour détecter la résistance à toutes les pénicillines. Les souches possédant une pénicillinase doivent être considérées comme résistantes à ces antibiotiques. On ne doit pas rendre un résultat de sensibilité comme « intermédiaire ».
Lorsqu’un doute persiste sur le fait qu’une souche produise ou non une pénicillinase, sa détection peut être faite par test de Gots, test acidimétrique, ou par un test iodométrique ou plus simplement par le test à la nitrocéfine.
bl La résistance intrinsèque ou résistance hétérogène à la méticilline :
— Description du phénomène
Ce mécanisme de résistance non enzymatique aux bêta-lactamines a été observé dès 1961, époque de l’introduction de la méticilline en thérapeutique. Les souches qui le possèdent sont dites résistantes hétérogènes à la méthicilline ou « méti R ». Chez une souche méti R, seule une faible proportion des bactéries est capable d’exprimer la résistance et de croître en présence de méticilline.
Les souches méti R doivent toujours être considérées comme résistantes à toutes les bêta-lactamines, y compris aux céphalosporines de 3e génération et à l’imipénème.
Elle sont également productrices de pénicillinases. Elles sont habituellement résistantes à d’autres antibiotiques : aminosides, tétracyclines et macrolides.
De 10 à 40 % des souches hospitalières de S. aureus isolées en France sont méti R.
Leur fréquence parmi les souches d’origine extra-hospitalière est faible.
Cette résistance est la conséquence de modifications des protéines enzymatiques intervenant dans la synthèse du peptidoglycane de la paroi bactérienne. Il existe chez S. aureus au moins quatre PLP (Protéines de Liaison à la Pénicilline) encore appelées PBP (Penicillin Binding Protein). Chez les souches méti R on observe une diminution de l’affinité des PBP pour les bêta-lactamines et la synthèse d’une PBP anormale, la PBP 2a dont l’affinité pour les bêta-laetamines est faible.
— Détection de la résistance hétérogène
II existe des souches résistantes homogènes à haut niveau à la méticilline. Leur détection par antibiogramme ne pose pas de problème.
Plus souvent la résistance est hétérogène et seule une faible fraction des bactéries est capable d’exprimer sa résistance dans des conditions standards de culture. Pour favoriser l’expression de cette résistance à la méticilline sur antibiogramme il est nécessaire de placer un disque de méticilline (ou d’oxacilline qui est plus stable) :
– soit sur une boîte de gélose de Mueller-Hinton incubée entre 25 et 30°C et observée après 24 et 48 heures.
– soit sur une boîte de gélose de Mueller-Hinton hypersalée (5 % de NaCl) et incubée à 37°C.
Dans ces conditions, la résistance hétérogène se traduit par la présence de petites colonies dans la zone d’inhibition autour du disque. Ces colonies sont mieux visibles après une incubation de 48 heures
Une résistance à la méticilline doit faire considérer la souche comme résistante à toutes les bêta-lactamines. Les expérimentations cliniques ont montré que ces souches étaient effectivement résistantes aux céphalosporines. En pratique, sur l’antibiogramme il n’est utile de tester qu’un seul disque : méticilline ou oxacilline.
La résistance hétérogène s’exprimant mal autour des disques de céphalosporines, il est donc inutile de les employer.
En cas de doute sur la mise en évidence de la résistance intrinsèque par antibiogramme il est intéressant d’employer la technique de dilution en gélose. Une dilution de la souche à tester (spot contenant 104 CFLJ) est ensemencée sur une boîte de gélose de Mueller-Hinton à 5 % de NaCl contenant 10 mg/1 de méticilline ou 6 mg/1 d’oxacilline. La croissance de la souche sur cette boîte après 24 à 48 h à 35°C la fait considérer comme résistante à toutes les bêta-lactamines.

cl La tolérance :
Les bêta-lactamines sont des antibiotiques bactéricides. Les concentrations minimales inhibitrices (CMI) et les concentrations minimales bactéricides (CMB) sont normalement voisines.
Le rapport CMB/CMI est de l’ordre de 1 à 2.
La tolérance est un mécanisme de résistance particulier où la CMI est normale mais où la souche n’est lysée que par des CMB très supérieures à la CMI. Une souche est dite tolérante lorsque la CMB est au moins 32 fois supérieure à la CMI.
Ce phénomène concerne tous les antibiotiques intervenant dans la biosynthèse de la paroi (bêta-lactamines, mais aussi vancomycine, fosfomycine) avec parfois des tolérances croisées comme entre les bêta-lactamines et la vancomycine. Cette tolérance est liée à un système peptidoglycane-hydrolase intrinsèque inopérant (défectif). La tolérance est phénotypique, c’est-à-dire réversible et instable. Les souches de S. aureus tolérantes sont surtout rencontrées dans les endocardites ; la fréquence actuelle ainsi que la signification de telles souches sont mal établies.
2. Les autres antibiotiques :
al Les aminosides :
Ils peuvent être modifiés par diverses enzymes staphylococciques : phosphotransférases, nucléotidyltransférases et acétyltransférases.
Les souches résistantes à la gentamicine sont aussi résistantes à la tobramycine et à la kanamycine (phénotype KTG) et présentent une sensibilité diminuée à la nétilmicine et à l’amikacine, quels que soient les diamètres d’inhibition observés pour ces 2 derniers antibiotiques. De plus, la CMB de l’amikacine est beaucoup plus élevée chez ces souches. En pratique, les souches de S. aureus résistantes à la gentamicine doivent être considérées comme résistantes à tous les aminosides usuels (sauf à la streptomycine et à la néomycine qu’il faut tester séparément).
Les souches résistantes à la tobramycine et à la kanamycine (phénotype KT) sont résistantes aussi à l’amikacine et la néomycine mais restent sensibles à la gentamicine et à la nétilmicine.
Les souches présentant le phénotype K Nm (résistance à la kanamycine et à la néomycine) sont également résistantes à l’amikacine.
Ces souches résistantes aux aminosides (particulièrement le phénotype KTG) sont le plus souvent méti R.
bl La vancomycine et la teicoplanine :
Constamment actives sur les S. aureus même méti R, elles sont utilisées uniquement en milieu hospitalier, particulièrement dans les endocardites et les infections graves. La sensibilité des staphylocoques à coagulase négative à la teicoplanine est moins constante et doit être vérifiée au laboratoire.
cl Les macrolides :
En milieu hospitalier, environ 25 % des souches de S. aureus résistent à l’érythromycine et un pourcentage un peu plus faible résiste aux lincosamides (lincomycine, clindamycine). Moins de 5 % des souches sont résistantes aux synergistines (pristinamycine, virginiamycine).
La résistance peut être constitutive, c’est-à-dire non induite, et concerne les macrolides, lincosamides et streptogramines B (résistance Les streptogramines A ne sont pas atteintes et la synergie entre et persiste in vitro ; la sensibilité à la pristinamycine et à la virginiamycine semble donc conservée.
Certaines souches de S. aureus présentent une résistance aux MLSg induite par l’érythromycine ou l’oléandomycine. Ces souches sont sensibles à certains macrolides (spiramycine, josamycine, midécamycine), aux lincosamides et aux streptogramines A et B. Par contre elles sont résistantes à l’érythromycine et à l’oléandomycine.
L’association de traces d’un de ces deux derniers antibiotiques à l’un des autres antibiotiques du groupe MLS induit une résistance MLSg identique au type constitutif.
Le phénotype de résistance isolée à la lincomycine seule ou associée à la résistance aux streptogramines A (LS^) est encore rarement rencontré en France.
dl Le chloramphénicol, les cyclines et le cotrimoxazole :
Ils ne peuvent être considérés comme des antistaphylococciques de choix.
el La rifampicine :
Elle reste très active mais doit toujours être utilisée en association pour éviter la sélection de mutants résistants.
// Autres antibiotiques
Ils viennent prendre une place intéressante parmi les antibiotiques antistaphylococciques, même pour traiter les souches méti R, à condition d’être utilisés en association ; il s’agit de :
– l’acide fusidique
– la fosfomycine (95 à 100 % de souches sensibles)
– les fluoroquinolones (péfloxacine, ofloxacine, ciprofloxacine…).
En pratique, là où l’antibiothérapie bactériostatique est suffisante (infection ORL, cellulites, furoncles,…) on peut utiliser des produits du type pristinamycine, mais pour les infections graves (septicémies, endocardites, pneumopathies, ostéomyélites, choc toxique,…) on doit obtenir un effet bactéricide et on peut utiliser :
– si la souche est méti S, une association bêta-lactamine (oxacilline ou céfalotine) – et aminoside, – si la souche est méti R, des associations vancomycine et aminoside combinées ou non à la rifampicine, ou bien péfloxacine associée à la fosfomycine ou à un aminoside ou bien parfois céfotaxime-fosfomycine. Le choix est alors guidé par les études d’activités bactéricides des associations in vitro, et éventuellement par l’étude du pouvoir bactéricide du sérum sur la souche impliquée.
Les souches appartenant à des espèces autres que S. aureus sont fréquemment multirésistantes et méti R (35 à 66 % des souches) ; elles sont toutes sensibles à la vancomycine.
Signalons que la fosfomycine est toujours inactive sur S. saprophyticus.
Les plus grandes difficultés thérapeutiques sont rencontrées avec les endocardites ou les méningites à S. epidermidis et, dans ces cas, l’étude in vitro d’associations est nécessaire.
A noter enfin que certaines souches de staphylocoques peuvent acquérir des résistances vis-à-vis d’antiseptiques notamment mercuriels, ce qui peut favoriser la diffusion de telles souches en milieu hospitalier.
B – Prophylaxie :
1. Individuelle :
Le portage sain ne constitue pas un danger pour le sujet lui-même. Mais chez un sujet porteur de furonculose chronique, il faut éliminer ce portage.
Lors d’une lésion staphylococcique évolutive, il faut éviter une septicémie. Des essais de vaccins à base de staphylocoques ou d’anatoxine n’ont pas débouché sur des résultats convaincants.
2. Collective :
II conviendrait théoriquement d’éviter l’emploi de porteurs de germes dans la restauration collective.
La lutte contre les staphylocoques hospitaliers est un problème fondamental d’hygiène hospitalière fondé sur l’observation des règles d’asepsie, l’éducation du personnel et la rationalisation de l’emploi des antibiotiques.

Vous devez être connecté pour poster un commentaire.