Introduction :
Introduction :
L’idée a été formulée à la fin du XIXe siècle qu’une hypertension pouvait conduire à une sclérose rénale, et c’est Volhard et Fahr, en 1914, qui ont introduit le terme de « néphrosclérose hypertensive ». Ce concept reste discuté. S’il est parfaitement clair qu’une hypertension maligne peut conduire à une insuffisance rénale terminale, l’idée qu’une hypertension bénigne puisse aboutir au même résultat est loin d’être admise par tous.
Il est classique de dire que le rein est à la fois coupable et victime de l’hypertension. L’approche « guytonienne » de l’hypertension a trouvé droit de cité dans les années 1970.
Non seulement nul n’est venu la contredire, mais les preuves se sont accumulées et se sont renforcées avec le temps. Dans cette approche, aucune hypertension ne peut être permanente si la fonction rénale est normale, et non obérée par une anomalie de l’équilibration du bilan sodé (fonction dévolue au seul rein). En ce sens, le rein est effectivement le « coupable » fondamental.
La vision opposée est que la physiologie rénale ne saurait rester indifférente à un niveau de pression élevé. L’hémodynamique rénale est vite modifiée, à vrai dire surtout dans les hypertensions assez sévères. Avec le temps, ces modifications ne sont plus seulement fonctionnelles et apparaissent des lésions anatomiques, dites de « néphroangiosclérose ». À long terme survient une insuffisance rénale plus ou moins sévère, mais atteignant parfois le stade terminal. Ce problème est un peu considéré comme une rareté, voire une curiosité pour néphrologues dans notre pays. Il est au contraire une réalité bien tangible, fréquente, aux États-Unis dans la population afro-américaine.
C’est donc un cercle vicieux qui est engagé entre le rein et la maladie hypertensive. Comme tout cercle vicieux, celui-ci pose la question de « la poule et l’oeuf » et l’idée qu’une néphropathie puisse précéder l’hypertension et en être responsable est défendue par un nombre croissant d’auteurs.
Définitions :
Deux affections assez différentes sont répertoriées sous ce terme.
La plus fréquente, décrite ici, est la néphroangiosclérose « bénigne ». C’est une maladie rénale progressive, conséquence tardive d’une hypertension prolongée, qui n’est en général non ou mal traitée. Ses lésions anatomiques sont vasculaires, scléreuses, aboutissant tardivement à l’obsolescence glomérulaire, puis à une fibrose interstitielle. Elle évolue progressivement vers l’insuffisance rénale. L’insuffisance rénale terminale est surtout observée chez les sujets noirs américains. Dans les populations caucasiennes l’insuffisance rénale est tardive, moins évolutive, et il est assez rare qu’elle évolue vers le stade terminal. Cela est en relative discordance avec les données figurant sur les registres de dialyse telles qu’elles sont indiquées plus loin.
Complètement différente est la néphroangiosclérose « maligne ».
Elle survient brusquement, dans le cadre bruyant d’une hypertension « maligne » ou « accélérée », caractérisée par des chiffres tensionnels très élevés, un riche cortège symptomatique, des altérations majeures du fond d’oeil, parfois une insuffisance cardiaque gauche aiguë. L’insuffisance rénale évolue très rapidement en quelques semaines vers le stade ultime, elle est le plus souvent irréversible. Ses lésions anatomiques sont différentes de celles observées dans la forme chronique, marquées par des lésions vasculaires et glomérulaires aiguës constituées de nécrose fibrinoïde et de thromboses. Ce type de néphroangiosclérose est devenu très rare de nos jours. Nous ne l’envisagerons pas en détail ici.
Fréquence. Épidémiologie :
Il n’existe pas de données épidémiologiques réellement fiables. Est en effet considérée « néphroangiosclérose » toute insuffisance rénale chronique sans autre cause connue que l’hypertension. Les données issues des registres de mise en dialyse fournissent une approximation de la fréquence, au moins estimée, de la néphroangiosclérose, mais biaisée par l’incertitude du diagnostic. Les données issues des biopsies rénales donnent des informations infiniment plus rigoureuses, mais leur limite est celle des indications, relativement sélectives, de cet examen.
Registres de dialyse :
L’incidence d’une insuffisance rénale terminale liée à l’hypertension serait aux États-Unis de 1 pour 2 200 hypertendus. Elle est stable ou en très légère progression depuis une dizaine d’années.
Les données de l’US Renal Data System font état de 63 800 patients dialysés avec l’hypertension comme cause présumée de leur maladie rénale, ce qui représente 25 % de la population des dialysés, et en fait la deuxième cause après le diabète. En incidence, l’hypertension justifierait 29 % des nouveaux cas de mise en dialyse. À noter que l’hypertension est le diagnostic présumé chez 36,8 % des Noirs américains contre 26 % chez les ujets blancs. La fréquence serait un peu moindre en Amérique latine, 21 à 22 %. Les données du registre européen de l’European Dialysis and Transplant Association (EDTA) (n’incluant pas la France) indiquent une incidence annuelle sensiblement plus faible, représentant 12 % des mises en dialyse. La fréquence semblerait plus basse encore en Asie, avec des taux de 6 % pour le Japon et de 7 % pour la Chine.
Il est à remarquer, par contraste, que ce taux est de 24 % pour les patients d’origine asiatique dialysés aux États-Unis.
Certains auteurs ont souligné que le traitement antihypertenseur a apporté une amélioration importante du pronostic cardiovasculaire des hypertendus, permettant peut-être à un plus grand nombre d’entre eux d’atteindre une phase avancée de leur maladie rénale. Par ailleurs, toutes ces données sont très sensibles à l’âge limite de mise en dialyse dans les régions considérées.
Données de biopsies rénales :
Tout différent est l’abord fourni par les études de biopsies rénales. Le Norwegian Kidney Register renferme les données de toutes les biopsies rénales pratiquées dans ce pays. Sur une période de 2 ans (1988-1990), 1 176 biopsies rénales ont été pratiquées, et 102 ont conclu à une néphroangiosclérose.
Les biopsies montrant toute autre forme de néphropathie, y compris diabétique, étaient exclues. Donc 8,7 % de toutes les biopsies rénales pratiquées dans ce pays sur une période de 2 ans ont montré une néphroangiosclérose. D’autres données biopsiques, mais ne disposant pas de cette exhaustivité, ont été rapportées. Au Danemark, la néphroangiosclérose représenterait 2,1 % des biopsies, et au Royaume-Uni 2,5 %.
Resterait néanmoins à savoir quels patients sont biopsiés et sur quels critères, car une pondération s’impose très probablement.
Tableau clinique :
La néphroangiosclérose est une pathologie d’une remarquable discrétion clinique, totalement asymptomatique durant de nombreuses années chez la plupart des patients. Une perte progressive du pouvoir de concentration de l’urine peut se produire, conduisant à une nycturie, rarement importante ou très gênante. C’est donc presque toujours une découverte de la surveillance systématique de la fonction rénale. Contrairement à ce qui est observé dans la néphroangiosclérose maligne, il n’y a souvent pas de lésions majeures au fond d’oeil.
Biologiquement, la néphroangiosclérose se présente comme une insuffisance rénale progressive, très lentement évolutive.
La protéinurie y est faible, parfois même nulle, et le sédiment urinaire est presque toujours normal. En radiographie ou en échographie, les reins apparaissent de taille normale (au moins initialement) ou un peu réduite, ils sont bien symétriques et de contour parfaitement harmonieux. Le doppler artériel ne montre qu’un amortissement symétrique des flux. Il s’agit donc d’une insuffisance rénale assez nue, sans le syndrome urinaire des néphropathies glomérulaires, et sans les anomalies du contour des reins observées dans nombre de néphropathies interstitielles. Une angiographie n’est plus guère pratiquée de nos jours, sauf hésitation diagnostique particulière. Elle montre un appauvrissement des plus fines ramifications artérielles de la corticale, qui apparaissent tortueuses, irrégulières, et raréfiées.
Dans l’étude mentionnée plus haut du registre norvégien, les patients étaient âgés en moyenne de 55 ans, ils avaient une créatinine plasmatique de 165 μmol et une protéinurie de 0,35 g 24 h–1, la maladie rénale était connue depuis 1 an. Le suivi des patients a été de 12 ans (0,1 à 13,6). Une insuffisance rénale terminale est apparue chez 26,4 % des patients durant cette période moyenne de suivi. L’âge, la créatinine initiale et la protéinurie étaient les principaux facteurs prédicteurs de cette évolution.
La microalbuminurie est de plus en plus surveillée chez les hypertendus. Si elle apparaît très clairement comme le marqueur d’un risque cardiovasculaire très accru, elle n’a pas, à ce jour, été documentée de manière très convaincante comme annonciatrice d’une néphroangiosclérose.
Anatomie pathologique :
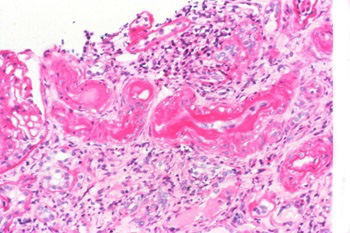
Les lésions histologiques de la néphroangiosclérose sont relativement peu spécifiques. Toutefois, s’il n’existe pas de tableau vraiment caractéristique, la biopsie rénale a au moins l’intérêt majeur d’éliminer une néphropathie d’un autre type.
Les lésions histologiques sont pour l’essentiel artérielles et artériolaires. Au niveau des artères interlobulaires, il existe un épaississement de l’intima, infiltrée par un tissu collagène dense, periodic acid Schiff (PAS) positif, et une multiplication des lames élastiques, rétrécissant la lumière. La média est souvent épaissie.
Les artérioles, principalement afférentes, sont le siège de dépôts hyalins sous-endothéliaux plus ou moins extensifs, parfois d’une hyperplasie des cellules musculaires lisses, et de divers degrés de sclérose. Les artères de plus gros calibre sont le siège d’un athérome variable, reflétant la situation vasculaire basale.
En aval, les glomérules sont « ischémiques », avec un flocculus rétracté, élargissant la chambre urinaire. Avec le temps, la cellularité du flocculus diminue, des lésions de fibrose apparaissent, qui s’étendent progressivement à tout le flocculus ; ce glomérule évolue alors vers l’aspect de « pain à cacheter ».
Parallèlement à la constitution de cette glomérulosclérose, une atrophie tubulaire et une fibrose de l’interstitium sont généralement observées. Cette fibrose est souvent le siège d’infiltrats lymphoplasmocytaires.
Ces lésions sont très proches de celles observées lors du vieillissement rénal, même chez des sujets non hypertendus.
L’hypertension pourrait simplement amplifier ce phénomène physiologique et l’avancer dans le temps. Mais le diagnostic peut également être litigieux avec certaines hyalinoses segmentaires et focales. Plus les lésions sont avancées, plus la certitude diagnostique est fragile.
Facteurs de risque :
Dans les populations, le risque rénal est lié au niveau de pression artérielle :
Diverses études ont considéré dans une population les sujets devenant insuffisants rénaux, et analysé les paramètres les séparant du reste de la population. La pression artérielle y occupe une place de choix, ce qui n’est pas la preuve formelle d’une filiation.
Selon l’étude NHANES, 3 % de la population américaine aurait une créatinine élevée (au seuil de 141 μmol pour les hommes et 124 pour les femmes). Parmi ces sujets, 70 % sont hypertendus et 75 % des hypertendus sont traités. Les pressions plus élevées sont associées à une plus grande fréquence d’insuffisance rénale. Le traitement en cours est généralement insuffisant, la pression artérielle (PA) sous traitement restant très au-dessus des valeurs préconisées par les recommandations.
Comme il est banal lorsque le contrôle de la PA est défectueux, 48 % de ces sujets sont en monothérapie.
Tozawa et al. ont suivi 98 000 sujets de la population générale d’Okinawa (Japon), qui avaient eu une évaluation médicale en 1983. Après 17 ans, 0,4 % de ces sujets étaient dialysés. Le risque d’une telle évolution était, là encore, étroitement corrélé à la PA au début de l’étude. Il faut néanmoins mentionner que 5 % de ces sujets étaient déjà protéinuriques au départ, et même 16 % s’ils étaient porteurs d’une hypertension dite sévère, ce qui laisse planer un sérieux doute sur la filiation des événements. Pour cette raison, un ajustement statistique pour la protéinurie a été réalisé, et la relation avec la PA persistait en dépit de cet ajustement.
D’autres études de populations non sélectionnées ont de même constaté une relation entre le niveau de pression artérielle et le risque d’insuffisance rénale. Dans l’étude du Washington County (23 500 sujets), le risque relatif d’avoir une néphropathie augmentait parallèlement au stade d’hypertension.
Par rapport aux sujets ayant une pression artérielle « optimale » (< 120/80) ce risque était de 3,8 (0,8-17,2) pour une hypertension de grade 1, 6,3 (1,3-29) pour une hypertension de grade 2, et 8,8 (1,8-43) pour les grades 3 et 4. Dans la cohorte de Framingham, la survenue sur une période de 20 ans d’une insuffisance rénale (définie par une clairance de la créatinine estimée inférieure à 60 ml min–1) a été évaluée en fonction de tous les paramètres du risque cardiovasculaire.
L’hypertension était assortie d’un odds ratio de 1,57 (1,17-2,12).
La signification de ces données est cependant limitée. Elle se borne à indiquer que dans toute population, les sujets insuffisants rénaux ont de fortes chances d’être également hypertendus, et en général mal contrôlés. Qui plus est, l’hypertension s’intègre dans cette relation à d’autres facteurs. L’âge et un éventuel diabète ont un poids statistique plus important. Le niveau de la créatinine (ou de sa clairance) au début de l’étude est également un déterminant majeur dans toutes les études. À titre d’exemple, dans la cohorte de Framingham, l’odds ratio était de 2,36 pour l’âge, 3,01 pour une clairance initiale inférieure à 90 ml min–1, 2,6 pour un diabète, et le 1,57 associé à l’hypertension n’entrait pas dans le modèle multivarié.
Facteurs de risque chez les hypertendus :
Moins nombreuses ont été les études partant du phénotype hypertension, et évaluant chez ces patients lesquels étaient le plus à risque de développer une insuffisance rénale.
Celle de Perry et al. est, à cet égard, exemplaire. Ces auteurs ont étudié une cohorte de 12 000 vétérans américains, âgés de 52 ans en moyenne au début de l’étude, et suivis pendant au moins 14 ans. Tous les sujets étaient atteints d’une hypertension dite non compliquée lors de leur inclusion dans l’étude.
Les facteurs de risque significatifs de survenue d’une insuffisance rénale étaient la race noire, un diabète, un antécédent d’accident vasculaire cérébral (AVC) ou (mal défini) un « problème » urologique. L’âge et le tabagisme n’avaient pas d’impact significatif.
Les chiffres tensionnels avant traitement avaient un impact majeur. L’incidence
d’une insuffisance rénale terminale (IRC) est dix fois plus importante si la pression artérielle systolique (PAS) initiale est de plus de 180 mmHg, comparée aux sujets pour lesquelles elle est inférieure à 165 mmHg. Des valeurs du même ordre étaient trouvées pour la diastolique, la pression moyenne ou la pression pulsée. Le niveau de chacun de ces paramètres sous traitement avait également un impact significatif sur le risque d’insuffisance rénale. Le risque relatif d’insuffisance rénale était de 3 (2,09-4,55) pour les patients dont la PAS demeurait au-dessus de 150 mmHg par rapport à ceux pour lesquels elle était inférieure à 125. Le fait d’avoir une baisse de plus de 20 mmHg de la PAS sous traitement était assorti d’un risque relatif de 0,39, autrement dit, divisait par presque trois le risque d’insuffisance rénale. Enfin, la survenue d’un infarctus myocardique ou d’une insuffisance cardiaque durant la période d’étude majorait lourdement le risque d’une insuffisance rénale.
Vupputuri et al. ont suivi une cohorte de 722 hypertendus (dont 504 Noirs). Ils ont trouvé que chaque déviation standard vers le haut de la PAS (18 mmHg) et de la pression artérielle diastolique (PAD) (11 mmHg) était associée à un déclin annuel de la filtration glomérulaire de –0,92 et –0,83 ml min–1 respectivement.
Les patients dont la pression artérielle sous traitement dépassait 160/95 avaient un risque relatif de 5,21 d’un déclin précoce de la fonction rénale.
Des constatations analogues ont été faites sur les populations incluses dans de grandes études thérapeutiques. Dans la population examinée pour inclusion dans l’étude MRFIT, après tous ajustements pour l’âge, l’ethnie, la catégorie socioprofessionnelle, le cholestérol, le diabète, le risque relatif d’insuffisance rénale terminale était de 5 (3,7-6,7) pour le quintile supérieur de PAS. Les courbes de survie rénale en fonction du niveau de pression artérielle étaient superposables à celles de Perry. De même dans SHEP, parmi 2 181 sujets de plus de 65 ans atteints d’une hypertension systolique pure (bras placebo de l’étude), le risque relatif d’insuffisance rénale était de 2,44 pour le quartile le plus élevé de pression artérielle par rapport au plus bas.
Comme il a déjà été dit, les études européennes ont fourni des éléments différents. Ainsi, dans une cohorte britannique de 176 patients suivis pendant 12 à 14 ans, il n’a été observé aucune insuffisance rénale, a fortiori terminale, quel que soit le degré de sévérité de l’hypertension. Dans une cohorte suédoise de 686 patients suivis pendant 20 ans, seuls 1,7 % des patients ont eu une modeste élévation de la créatinine (139 μmol l–1) sans autre explication, et aucune insuffisance rénale terminale n’a été observée. Même à New York où Madhavan et al. ont suivi pendant 5 ans 2 125 patients porteurs d’hypertensions légères à modérées. Moins de 2 % de ces patients ont atteint une créatinine plasmatique de 177 μmol ou plus. Certes, le suivi était relativement court, mais les auteurs insistent sur le fait que ce petit groupe de patients ayant développé une insuffisance rénale (3 % des sujets noirs et 1,4 % des sujets blancs) se singularisait par l’existence d’une protéinurie initiale dans 31 % des cas. Les auteurs en ont conclu que les sujets augmentant leur créatinine dans ce délai souffraient probablement d’une néphropathie préexistante.
Physiopathologie : conséquences rénales de l’hypertension artérielle
Comme dans bien d’autres domaines, ce sont les données obtenues en expérimentation animale qui permettent d’asseoir quelques certitudes sur les mécanismes par lesquels une hypertension peut engendrer une insuffisance rénale. Il est possible alors d’en tirer quelques déductions sur les constatations faites en pathologie humaine.
Les conséquences rénales de l’hypertension sont liées à trois facteurs :
• le niveau de la « charge » tensionnelle systémique ;
• le degré auquel elle est transmise à la circulation glomérulaire ;
• des facteurs tissulaires de sensibilité au « barotraumatisme ».
Expérimentation animale :
Effet mécanique de la pression :
La relation entre pression artérielle et lésions vasculaires rénales a été largement étudiée dans des modèles expérimentaux.
Le plus classique à cet égard est le modèle de Goldblatt « deux reins un clip », comportant donc une sténose d’une des deux artères rénales. L’intérêt de ce modèle est que le rein en aval du clip ne subit pas l’effet de la pression accrue, seul le rein controlatéral intact étant exposé. De ce côté apparaissent très rapidement des lésions hyalines, segmentaires, traduisant une exsudation plasmatique et des nécroses focales de la média.
Fait intéressant, ces lésions apparaissent avant même que l’hypertension ne soit établie (mais les mesures continues objectivent une instabilité de la pression artérielle à cette phase très précoce, avec de nombreux pics tensionnels). Environ 2 semaines après la pose du clip, le rapport paroi-lumière des vaisseaux est augmenté par épaississement de la média. Les lésions nécrotiques se font alors plus rares dans les artères interlobulaires, suggérant que l’hypertrophie de la média exerce un certain effet protecteur. Avec le temps, l’épaississement des parois se poursuit et apparaissent une ischémie et une sclérose glomérulaires. Autre fait marquant et pertinent à la clinique humaine, l’ablation du clip après quelques mois ne fait plus cesser l’hypertension. Celle-ci est donc autoentretenue par les lésions vasculaires du rein controlatéral. Et de fait, si l’on retire celui-ci, la PA revient à la normale. Ces faits illustrent le phénomène d’autoaggravation de l’hypertension et des lésions vasculaires rénales.
Autorégulation :
Cet effet mécanique de la pression sur les vaisseaux glomérulaires est en réalité singulièrement nuancé par le degré auquel les variations de la pression systémique sont transmises à la circulation glomérulaire. En effet, celles-ci sont normalement amorties par une réponse myogénique de l’artériole afférente, sous la dépendance du NO. Cette réponse est potentialisée par le rétrocontrôle tubuloglomérulaire provenant de la macula densa. Toute augmentation de la pression artérielle est donc accompagnée d’une vasoconstriction de l’artère afférente qui amortit sa transmission en aval. Il en résulte une autorégulation de la pression et du flux glomérulaires, dont l’effet protecteur est évident.
Cette autorégulation est elle-même largement modulée par des facteurs génétiques. Elle est par exemple déficiente dans une souche de rats spontanément hypertendus, dits fawn-hooded.
Ces animaux, dont la résistance de l’artériole afférente est très basse, développent précocement une néphroangiosclérose sévère en dépit de chiffres très modestes de pression artérielle. Van Dokkum et al. ont montré qu’il existe au moins deux gènes qui conditionnent la susceptibilité de ces animaux à l’insuffisance rénale. Leurs loci ont été identifiés et diffèrent de ceux contrôlant l’hypertension. Les hybrides F1 de rats fawn-hooded avec des animaux normotendus de souche ACI (donc hétérozygotes pour ces deux gènes) sont, à niveau identique de pression artérielle, protégés de la glomérulosclérose résultant d’une hypertension induite par un inhibiteur non sélectif de la NO-synthase, L-NAME.
À l’inverse, les rats de souche SHR, qui ont des artérioles afférentes de lumière réduite, sont très peu sensibles à l’effet rénal de l’hypertension et développent peu de glomérulosclérose.
Churchill et al. ont transplanté un rein d’un rat normotendu Brown-Norway (BN) en remplacement d’un des deux reins d’un animal hypertendu (SHR), et induit une hypertension chez le receveur par l’administration de sel et de DOCA. Cette hypertension a induit une protéinurie, une baisse de filtration glomérulaire et une glomérulosclérose dans le rein BN transplanté et non dans le rein natif du SHR.
L’autorégulation peut être modifiée par des agents pharmacologiques. Ainsi, chez le SHR, les inhibiteurs de l’enzyme de conversion (IEC) conservent l’autorégulation, et tendent même à abaisser la pression glomérulaire par une dilatation de l’artériole efférente. À l’inverse, les inhibiteurs calciques abolissent l’autorégulation. La pression glomérulaire devient alors strictement dépendante de la pression systémique. Les lésions de glomérulosclérose induites par l’hypertension sont alors fortement majorées.
Enfin, l’autorégulation est fortement compromise lorsque le rein est en hyperfiltration. Le meilleur modèle expérimental en est la néphrectomie des 5/6, responsable d’une hyperfiltration majeure des néphrons restants, ainsi que d’un débit sanguin accru par néphron. Dans ce modèle, la constitution d’une glomérulosclérose est rapide et la sensibilité aux variations de la pression extrême. L’effet bénéfique d’une suppression du système rénine-angiotensine, qui normalise la pression glomérulaire, y est particulièrement spectaculaire. L’absorption d’un régime pauvre en protéines permet de préserver l’autorégulation et limite les lésions de glomérulosclérose malgré la persistance de l’hypertension. Là encore, l’adjonction d’un bloqueur calcique annule cet effet et la protection induite par la diététique est abolie.
Facteurs de susceptibilité tissulaire :
Il est impossible d’expliquer la totalité des constatations expérimentales (et humaines) sans admettre que d’autres facteurs, indépendants de la pression, induisent une susceptibilité particulière des glomérules. Ces facteurs ne sont pas clairement identifiés. Ils agiraient par une voie commune d’induction de radicaux libres générant un stress oxydatif, d’activation de facteurs de croissance, et de médiateurs de la fibrogenèse, tels le transforming growth factor-b (TGF-b) et le plasminogen activator inhibitor 1 (PAI-1). Une action délétère sur les podocytes, altérant le support mécanique que ceux-ci offrent à la structure glomérulaire, a aussi été évoquée.
L’induction de ces facteurs a été largement imputée au système rénine-angiotensine. De fait, outre ses actions pressives et hémodynamiques propres, l’angiotensine II active la fibrogenèse rénale, stimule la production du TGF-b, majore le stress oxydatif, et enfin stimule différents facteurs locaux d’inflammation mésangiale. Il n’est pas aisé de séparer, au sein des nombreuses actions de l’angiotensine II, ce qui est dépendant ou non de la pression. Néanmoins, des travaux récents suggèrent qu’une partie de ces actions est effectivement indépendante de la pression.
L’aldostérone est le dernier en date des facteurs incriminés. Il est connu de longue date que dans le modèle de néphrectomie subtotale, le traitement par un inhibiteur de l’enzyme de conversion permet de freiner considérablement la protéinurie et le développement des lésions de glomérulosclérose.
Dans cette situation, une perfusion d’aldostérone restaure l’évolutivité de ces lésions malgré le blocage persistant du système rénine-angiotensine. À l’inverse, le blocage des récepteurs de l’aldostérone a un bon effet préventif sur ce type de néphropathie. L’aldostérone pourrait ainsi être un facteur de la fibrogenèse rénale.
Rocha et al. ont montré d’une manière très convaincante que la spironolactone chez le rat hypertendu « stroke prone » (SHRSP) réduit de manière très importante la protéinurie et la progression des lésions fibreuses glomérulaires, par une action indépendante de la pression artérielle.
L’aldostérone semble exercer également des actions « non génomiques ». Elle induit une vasoconstriction des artères afférentes, non bloquée par la spironolactone, éventuellement inhibée par la nifédipine, et reproduite par une inhibition de la synthèse de NO.
Données humaines :
Stade « fonctionnel » :
Flux sanguin rénal :
Le flux sanguin rénal est en général franchement abaissé dans les hypertensions sévères. Les constatations sont bien plus variables dans les hypertensions artérielles (HTA) « légères ». Il peut être normal, abaissé ou même parfois augmenté. C’est au stade le plus précoce, voire avant l’hypertension chez les sujets prédisposés, qu’une augmentation a été le plus souvent constatée.
Tel n’est pratiquement jamais le cas lorsque l’hypertension est installée depuis quelque temps. Dans un travail classique, G.
London et al. ont mesuré le flux sanguin rénal chez 131 patients porteurs d’une hypertension modérée sans complication et 67 sujets témoins normotendus. Le flux était diminué chez les hypertendus par rapport aux normotendus (739 versus 891 ml min–1 m–2). Qui plus est, la fraction rénale du débit cardiaque était également abaissée, alors que les fractions hépatique ou musculaire du débit cardiaque restaient inchangées. Il existe donc bien une ischémie spécifiquement rénale chez l’hypertendu. Chez ces sujets, l’altération du flux sanguin rénal est d’autant plus importante que les chiffres de pression artérielle sont élevés, elle se majore également avec l’âge du sujet et augmente avec le temps d’évolution. Il est à noter qu’elle est réversible sous traitement, particulièrement par un IEC, ce qui indique son caractère fonctionnel, du moins à ce stade.
Filtration glomérulaire :
La filtration glomérulaire est paradoxalement longtemps conservée chez ces sujets. En présence d’un flux sanguin abaissé, le maintien de la filtration glomérulaire suppose une augmentation de la fraction de filtration, donc une augmentation de la pression intraglomérulaire. Cette augmentation est minime au début et s’accentue au fur et à mesure de la baisse du flux sanguin rénal. Cette compensation explique que les anomalies, pourtant patentes, de l’hémodynamique rénale, ne sont longtemps pas apparentes sur les bilans biologiques simples qui sont réalisés chez ces patients.
Comment se répartit donc la résistance rénale ? La baisse du flux sanguin en dépit d’une pression élevée indique que la résistance rénale est globalement augmentée. Le fait que la filtration ne suive pas la pression indique que la résistance est largement préglomérulaire. Kimura et al. ont vérifié cette augmentation de la résistance artériolaire afférente, avec une pression glomérulaire et une résistance artériolaire efférente encore normales chez les hypertendus essentiels. En revanche, l’augmentation de la fraction filtrée constatée par London suggère qu’il existe également une modulation de la résistance postglomérulaire.
Plus récemment, Safar et al. ont montré qu’il existe une corrélation entre la clairance de la créatinine et la rigidité artérielle évaluée par la vitesse de l’onde de pouls chez les sujets à fonction rénale normale ou subnormale. Cette relation est indépendante de la pression artérielle moyenne (PAM), et des autres facteurs de risque cardiovasculaire. Elle indique que le lien entre pathologie rénale et hypertension ne se limite pas aux artérioles de résistance, mais implique également les grosses artères élastiques.
L’apparition d’une microalbuminurie est souvent le tout premier marqueur biologique d’altération rénale chez les hypertendus. Le mécanisme de sa survenue reste encore débattu. S’agit-il d’une simple conséquence « mécanique » de l’augmentation de la pression intraglomérulaire, s’agit-il d’un dysfonctionnement endothélial (reflétant sans doute un mécanisme bien plus diffus), ou d’un premier marqueur d’une lésion anatomique ? Sa réversibilité lorsque l’on abaisse la PA serait plus en faveur de la première hypothèse.
Autorégulation :
Certaines constatations faites en pathologie humaine sont très proches des connaissances acquises en expérimentation animale. Ainsi, pour une pression identique, les conséquences rénales de l’hypertension apparaissent bien plus importantes s’il existe une vasodilatation préglomérulaire, telle qu’elle est observée par exemple après une néphrectomie ou dans le diabète de type I. Encore dans ces cas s’agit-il d’une vasodilatation modérée, avec une autorégulation relativement préservée.
C’est sans doute ce qui explique les conséquences modestes d’une néphrectomie unilatérale et le long délai d’apparition des néphropathies diabétiques. Les lésions apparaissent et se majorent beaucoup plus rapidement dès lors que la réduction néphronique est plus importante.
Encore faut-il probablement distinguer le niveau continu ou moyen de PA et l’instabilité de la pression avec des pics ; chacun étant susceptible d’induire des lésions rénales.
Il existe chez l’homme également des influences génétiques patentes, comme en témoigne l’agrégation familiale des cas d’insuffisance rénale terminale chez les sujets porteurs de néphroangiosclérose. Celle-ci est par ailleurs connue comme bien plus fréquente chez les sujets noirs que blancs. Or, il a été montré chez les sujets noirs une moindre capacité d’autorégulation.
Kotchen et al. ont étudié des sujets noirs américains et caucasiens, hypertendus, qu’ils ont soumis à une perfusion à doses croissantes de norépinéphrine. Les sujets noirs avaient un flux sanguin rénal et une filtration glomérulaire de base plus élevés que les blancs, témoignant d’une relative hyperfiltration.
Sous l’influence de la norépinéphrine, le flux plasmatique rénal est resté inchangé dans les deux groupes. Au contraire, la filtration glomérulaire s’est fortement accrue chez les sujets noirs alors qu’elle est restée stable chez les sujets blancs.
Fernandez-Llama et al. ont étudié la répartition du polymorphisme insertion-délétion (ID) du gène de l’enzyme de conversion de l’angiotensine chez 37 sujets atteints d’une néphroangiosclérose histologiquement prouvée. Ils ont montré une forte asymétrie de cette distribution avec un génotype DD plus fréquent (57 % contre 25 % dans la population témoin) et un génotype DI plus rare (27 % contre 64 %). Il n’y avait aucune différence de distribution entre les hypertendus à fonction rénale normale et les témoins normotendus. Ces auteurs ont conclu que ce polymorphisme pourrait être un marqueur de la susceptibilité rénale à l’hypertension.
Récemment, Fabris et al. ont étudié les quatre principaux polymorphismes connus pour affecter le système rénineangiotensine- aldostérone (angiotensinogène, enzyme de conversion, récepteur AT1 et aldostérone-synthase). Ils ont trouvé une relation entre chacun de ces polymorphismes et l’existence d’une insuffisance rénale chez des sujets hypertendus.
Ils ont constaté également des interactions, positives ou négatives, entre les différents polymorphismes sur ce même critère.
Bien d’autres gènes-candidats ont été évoqués, entre autres l’endothéline, la NO-synthase, le TGF-b, le platelet derivated growth factor (PDGF)… leur étude n’a pas permis à ce jour d’apporter des conclusions décisives sur un rôle dominant de l’un d’entre eux.
Stade lésionnel :
Ces anomalies fonctionnelles rénales laissent place, avec le temps, à des lésions anatomiques et ce, d’autant plus facilement que la circulation glomérulaire est plus exposée et que la pression glomérulaire est plus élevée. La responsabilité directe du facteur mécanique de pression dans la genèse des lésions vasculaires d’une part, et glomérulaires d’autre part, peut être intuitivement admise par analogie avec ce qui est observé chez l’animal, particulièrement dans le modèle de Goldblatt. Elle est néanmoins difficile à prouver, et son rôle exclusif semble bien peu probable. D’une part, l’hypertension humaine est une situation complexe qui comporte tout un cortège d’anomalies susceptibles, par elles-mêmes, de générer des lésions vasculaires, voire glomérulaires. D’autre part, l’absence manifeste de corrélation entre le niveau de pression et l’existence de ces lésions indique assez bien que l’intervention d’autres facteurs est nécessaire pour qu’apparaisse la néphroangiosclérose.
Néphroangiosclérose, une erreur de diagnostic ?
Depuis 10 ou 20 ans, les données se sont accumulées montrant que le champ des lésions rénales « induites » par l’hypertension s’étend bien au-delà de la « néphroangiosclérose » dans son acception classique. L’existence d’une hypertension joue un rôle considérable dans l’aggravation de toute néphropathie, quelle qu’en soit l’origine. Or nombre de néphropathies, même à un stade très précoce, et pratiquement toutes à un stade avancé, s’accompagnent d’une hypertension. Celle-ci, à son tour, précipite l’évolution des lésions rénales.
Si l’on prend en compte l’absence de symptômes cliniques relativement spécifiques, une chronologie habituellement imprécise et le fait qu’une biopsie rénale n’est que très rarement pratiquée chez ces patients (encore les lésions histologiques sont-elles peu spécifiques), il est aisé de comprendre que la simple filiation de l’hypertension générant des lésions rénales puisse sembler un peu simpliste. L’hypothèse alternative serait que des lésions rénales préexistent, sont responsables de l’hypertension, et qu’il existe un cercle vicieux d’autoaggravation.
Fogo et al. ont minutieusement analysé les données de l’histologie rénale chez les patients de l’étude AASK. Cette étude portait sur des sujets afro-américains hypertendus et considérés comme atteints d’une néphroangiosclérose. Sur les 39 biopsies, 38 montraient un degré important d’artério- ou d’artériolosclérose, authentifiant le diagnostic. D’autres lésions coexistaient néanmoins, soit de hyalinose segmentaire des glomérules, soit clairement d’autre nature, y compris des embolies de cholestérol. Un travail ultérieur du même groupe a comparé ces lésions à celles constatées chez des hypertendus caucasiens, et montré des différences histologiques importantes. En particulier, les sujets noirs avaient plus volontiers une forme « solidifiée » de glomérulosclérose, les sujets blancs ayant surtout une forme « obsolescente ». Ces lésions n’étaient corrélées ni à l’âge, ni à la PA, et fort peu à la protéinurie. Les auteurs en ont conclu que ces phénotypes différents correspondaient probablement à des mécanismes lésionnels différents et que leurs données « ne corroborent pas l’idée d’un lien de causalité directe, tel que suggéré par le terme néphroangiosclérose, selon lequel l’hypertension est responsable d’une sclérose vasculaire qui, à son tour, engendre la glomérulosclérose ».
À l’inverse, diverses études histologiques ont été naguère rapportées chez des patients non insuffisants rénaux et normotendus. Il s’agissait soit de protéinuries isolées, soit de jeunes femmes ayant fait une prééclampsie, chez lesquelles l’on souhaitait éliminer une autre néphropathie. Dans les deux cas, la normotension était solidement établie, la fonction rénale était normale, et le geste biopsique se voulait un intérêt pronostique. Dans un nombre important de cas, seules des lésions vasculaires ont été constatées, avec ou sans hyalinisation des pôles vasculaires des glomérules. Cette simple constatation indique que de telles lésions sont compatibles avec une stricte normotension. Qui plus est, dans le suivi des jeunes femmes après prééclampsie, les patientes porteuses de ces lésions sont le plus souvent devenues hypertendues après quelques années, ce qui est très atypique, particulièrement chez des femmes jeunes.
Ces faits suggèrent fortement que les lésions de néphroangiosclérose ont précédé l’hypertension.
Avec le temps et les argumentations successives, le doute a évolué vers un fort scepticisme, conduisant certains auteurs à estimer que l’idée qu’une hypertension non maligne puisse par elle-même être responsable d’une insuffisance rénale terminale ne repose sur rien de consistant. Les analyses critiques du concept de néphroangiosclérose se sont dès lors multipliées.
Diagnostic d’approximation :
Comme évoqué plus haut, la séquence des événements est habituellement imprécise, non seulement dans la pratique clinique mais même dans les études qui sont supposées faire référence. Il est, de fait, peu d’études où l’absence de protéinurie et la normalité de la clairance de la créatinine aient été établies lors de la découverte de l’hypertension. En pratique clinique, la biopsie rénale n’est – à juste titre – qu’exceptionnellement pratiquée. Il en résulte que nombre de néphropathies à immunoglobulines A (IgA), de hyalinoses segmentaires et focales, voire de néphropathies interstitielles chroniques de toute nature, sont initialement méconnues, puis considérées comme des néphroangioscléroses, faute d’avoir été convenablement étiquetées en temps utile. Toutes les données statistiques que nous avons évoquées mentionnent une néphropathie d’origine hypertensive au seul motif qu’aucune autre cause que l’hypertension n’est connue. Il y a donc tout lieu de penser qu’il existe une surestimation importante de ce diagnostic. Et de fait, toutes les études qui se sont penchées sur ce problème confirment la fréquence des erreurs de diagnostic clinique.
Ainsi Schlessinger a étudié 43 patients candidats à une transplantation rénale chez lesquels avait été porté « sans ambiguïté » un diagnostic de néphroangiosclérose. Parmi les quelques patients qui avaient eu une biopsie rénale, aucun n’avait les caractéristiques histologiques de la néphroangiosclérose bénigne. Par ailleurs, il n’était possible de documenter la coexistence d’une hypertension et d’une fonction rénale encore normale que dans moins de 5 % des cas. Pour Kincaid-Smith, l’étude des reins retirés lors d’une transplantation chez des patients au diagnostic tout aussi affirmatif ne l’a qu’exceptionnellement confirmé.
Caetano et al. ont rapporté l’étude histologique rénale de 81 patients hypertendus atteints d’une insuffisance rénale modérée. Une néphroangiosclérose bénigne a pu être retenue comme diagnostic histologique dans 22 % des cas. Des lésions vasculaires plus atypiques, suggérant des épisodes d’hypertension maligne, étaient considérées dans 43 % des cas. D’autres néphropathies, glomérulaires primitives, étaient en cause dans 35 % des cas (environ la moitié de hyalinoses segmentaires et focales).
Une étude suédoise, déjà mentionnée plus haut, a suivi prospectivement une cohorte de 686 patients hypertendus sur une période de 20 ans, avec une surveillance minutieuse de la fonction rénale. Une augmentation de la créatinine a été observée chez 8,9 % de ces patients mais presque tous se sont avérés atteints d’une néphropathie d’autre nature. Il s’agissait de diverses néphropathies primitives, de néphropathies diabétiques, d’obstacles urologiques ou de sténoses artérielles rénales. Seuls 12 patients (1,7 %) avaient une créatinine très modestement élevée (139 μmol l–1 à 20 ans de suivi) sans explication autre que l’hypertension.
Zarif et al. ont étudié la population de neuf centres de dialyse de l’Ohio. Parmi ces patients 220 (37 %) étaient réputés avoir pour néphropathie d’origine une néphroangiosclérose. Quatre d’entre eux avaient été biopsiés, un seul avait une histologie compatible, les autres avaient une néphropathie à IgA, une hyalinose segmentaire et focale, et une néphropathie interstitielle chronique. Les auteurs ont testé chez les autres les critères de « phénotypage » de la néphropathie hypertensive.
Dans plus de 50 % des cas, les données disponibles étaient insuffisantes pour pouvoir se prononcer, et pour 14 % il ne pouvait s’agir que d’un diagnostic erroné. Les diagnostics erronés parcouraient toute la néphrologie, glomérulaire ou interstitielle, jusqu’à un rein de myélome et une néphropathie du virus de l’immunodéficience humaine (VIH).
Néphropathie ischémique :
L’entité qualifiée de néphropathie ischémique est facilement confondue avec la néphroangiosclérose et en constitue une alternative diagnostique importante. Elle est pourtant en principe très différente. La néphropathie ischémique est constituée de lésions en aval de sténoses plus ou moins bien caractérisées des artères rénales, entraînant une perfusion défectueuse du parenchyme, éventuellement au-dessous du seuil d’autorégulation. Cette ischémie active le système rénineangiotensine, qui contribue à la hausse de la PA et tend à instaurer un cercle vicieux avec les lésions vasculaires. Son mécanisme est donc très différent de celui de la néphroangiosclérose.
L’usage des antihypertenseurs doit y être plus nuancé, car le risque d’aggraver l’ischémie est patent. L’altération de la fonction rénale y justifie surtout la discussion d’une angioplastie, débat dans lequel nous n’entrerons pas ici. Enfin la néphropathie ischémique s’inscrit totalement dans le contexte d’une maladie athéromateuse diffuse et son traitement est largement celui du risque vasculaire. Au demeurant, si la ou les sténoses n’ont pas été diagnostiquées, le patient souffre d’une insuffisance rénale, a priori d’origine vasculaire, alors qu’il est hypertendu de longue date. Et il est évident qu’à un stade avancé de l’insuffisance rénale, la distinction entre ces entités devient de plus en plus difficile, y compris dans l’éventualité d’une histologie rénale. Ainsi Zucchelli et al. ont revu les biopsies rénales de 56 patients consécutifs chez lesquels avait été porté le diagnostic de néphroangiosclérose. Ce diagnostic n’était cohérent que dans 48 % des cas, tandis que 35 % avaient une vasculopathie rénale athéromateuse et/ou des embolies de cholestérol.
Néphropathie responsable et non conséquence de l’hypertension artérielle ?
L’idée est défendue avec de plus en plus d’insistance — et d’arguments — que l’anomalie primitive engendrant l’hypertension pourrait être bien souvent rénale (le « rein coupable »).
Les mécanismes qui en sont proposés sont divers et non exclusifs, et il est probable que chacun d’entre eux ne peut logiquement concerner qu’un sous-groupe de patients. Il existe néanmoins entre eux des traits d’union importants : ces anomalies sont pour la plupart évolutives et peuvent donc expliquer l’aggravation progressive de la néphropathie hypertensive.
Cette évolutivité a pour dénominateur commun l’hyperfiltration, à terme source majeure de sclérose glomérulaire. Le rein étant beaucoup plus vulnérable aux variations de pression dès lors qu’il est en hyperfiltration, l’on comprend aisément la boucle d’autoaggravation qui s’ensuit.
Une raison majeure de considérer le rein comme origine de l’hypertension réside dans les expériences de transplantation.
De nombreux travaux y ont été consacrés depuis la publication initiale de Dahl qui avait montré que « l’hypertension suit le rein ». Dans nombre de modèles d’hypertensions génétiques, si un rein d’un donneur hypertendu est transplanté à un receveur normotendu, ce dernier devient hypertendu, et inversement. En transplantation rénale humaine, des données aussi tranchées sont impossibles à obtenir, mais il est clair qu’une hypertension apparaît plus souvent chez les receveurs du rein d’un donneur hypertendu que si le donneur était normotendu.
Anomalie génétique de la réabsorption du sodium :
L’hypertension essentielle est volontiers associée à un trouble de l’excrétion rénale du sodium (Na). Tout suggère que ce trouble est constitutionnel, et concerne la réabsorption proximale du sodium. Parmi les différentes hypothèses d’anomalies génétiques pouvant expliquer ce trouble, celle d’une mutation d’une ou plusieurs des trois sous-unités de l’ a-adducine est sans doute la plus consistante et la plus avancée. Très tôt, d’élégantes théories ont suggéré que l’hypertension pourrait être le prix hémodynamique à payer en présence d’un tel trouble pour le maintien d’une balance sodée en équilibre.
L’hyperfiltration glomérulaire pourrait être le premier terme de cette compensation. En effet, s’il existe un excès de réabsorption proximale, limitant l’apport de sodium au néphron distal, la mise en jeu du rétrocontrôle tubuloglomérulaire conduit à une augmentation compensatrice de la filtration glomérulaire. De fait, Bianchi a montré que la filtration glomérulaire est plus élevée chez des sujets jeunes normotendus dont les deux parents sont hypertendus (donc a priori prédisposés à l’hypertension) que chez ceux dont les deux parents sont normotendus.
Cette idée a été confortée par des travaux plus récents. Barba et al. ont étudié la filtration glomérulaire et la réabsorption proximale du sodium chez 47 volontaires sains normotendus, qu’ils ont classés suivant la sensibilité de leur PA aux variations de l’apport sodé. Les sujets sensibles au sodium avaient la PA la plus élevée, bien que celle-ci reste dans la limite de la normale.
En régime normosodé, ces sujets avaient à la fois une filtration glomérulaire plus élevée et une réabsorption proximale du sodium plus élevée que les autres. La différence de filtration glomérulaire disparaissait en régime pauvre en sel. Cette même constatation de l’augmentation de la pression et de la filtration glomérulaire chez les sujets sensibles au sodium a été faite par Weir.
Le travail de Kotchen, déjà mentionné plus haut, a montré une hyperfiltration chez les sujets noirs américains hypertendus et la même constatation a été faite par Parmer. Palatini et al. ont confirmé récemment une hyperfiltration chez des sujets jeunes porteurs d’hypertensions limite, surtout s’ils avaient une microalbuminurie.
L’idée est donc largement acquise qu’une hyperfiltration est commune au stade le plus précoce d’une maladie hypertensive et qu’elle a même toutes chances de précéder l’augmentation de PA. Comme nous l’avons vu plus haut, cette hyperfiltration n’a qu’un temps, et s’estompe progressivement lorsque l’hypertension est installée depuis des années.
Un nombre de néphrons réduit à la naissance ?
Brenner a suggéré que l’HTA pourrait être liée à un nombre réduit de néphrons à la naissance, responsable d’une hyperfiltration compensatrice. Celle-ci expliquerait alors non seulement l’apparition de l’hypertension, mais aussi la néphropathie ultérieure.
Des arguments très solides ont été développés en faveur de cette idée. Parmi diverses études, particulièrement convaincante, est celle, récente, dans laquelle ont été comparés les reins de dix hommes hypertendus et de dix autres, normotendus, décédés lors d’accidents de la route. Les hypertendus avaient moitié moins de néphrons que les normotendus (702 379 contre 1 429 200), et leurs glomérules étaient hypertrophiques.
Au demeurant, le compte et la mesure des glomérules ne sont pas un travail si simple. Hoy et al. ont rapporté une étude portant sur des reins d’autopsie provenant de sujets d’ethnies très diverses. Ils ont observé une variation du nombre des glomérules d’un facteur 9, et une variation de leur volume d’un facteur 5,6. Il n’y avait pas de différence interethnique franche.
Néanmoins, les auteurs ont observé une corrélation forte entre le nombre et le volume des glomérules. Cette observation leur a suggéré que l’augmentation du volume des glomérules pourrait être un facteur compensateur de la réduction de leur nombre, et représenter alors un facteur de susceptibilité à l’insuffisance rénale.
Un nombre réduit de néphrons suffit-il à expliquer une hypertension ? Les données obtenues après une néphrectomie unilatérale chez l’adulte (donneurs de reins par exemple) sont un peu discordantes, mais dans l’ensemble, l’impression qui prévaut est que cette néphrectomie n’induit pas une hypertension, même avec un très long recul. Une néphrectomie chez le très jeune enfant (en raison d’une tumeur le plus souvent) semble s’accompagner plus volontiers d’une hypertension à l’âge adulte. À l’extrême, chez le rat, une néphrectomie pratiquée dans les heures suivant la naissance entraîne régulièrement et rapidement une hypertension, alors qu’elle est sans effet plus tard. Ces données suggèrent que la réduction du nombre de néphrons n’est pas seule en cause, mais aussi le moment où elle intervient, et donc les possibilités d’hypertrophie compensatrice de ces néphrons, or, c’est celle-ci qui est la clé de l’hyperfiltration.
Une programmation durant la vie intra-utérine ?
Barker a publié une longue série de travaux indiquant qu’une souffrance foetale chronique avec naissance hypotrophe est associée à une fréquence bien plus élevée d’hypertension et de diabète à l’âge adulte. Ce concept a été validé par de nombreuses études, même s’il reste quelque peu controversé.
Law et Shiell ont passé en revue 21 études qui montraient presque toutes une PAS plus basse à l’âge adulte pour chaque tranche de poids de naissance supplémentaire. Cette idée de « perinatal programming » a suscité de multiples hypothèses pathogéniques. Cette relation a été imputée à une « malnutrition » foetale, liée soit à une malnutrition maternelle, soit à une hémodynamique placentaire déficiente. Une hypothèse alternative incriminerait plutôt la croissance rapide (croissance « de rattrapage ») qui suit une naissance hypotrophe. Cette croissance accélérée serait source d’un hyperinsulinisme, et ferait ainsi le lit du syndrome métabolique et de l’hypertension.
Expérimentalement, une ischémie placentaire en fin de gestation (clip aortique) donne naissance à des enfants de poids réduit, qui développent rapidement une hypertension. De même, plusieurs études de restriction protéique maternelle chez l’animal ont montré que les enfants nés de ces gestations avaient un nombre réduit de glomérules, surtout si la restriction protéique a porté sur la fin de la gestation. Il a été également montré que ces animaux à glomérules moins nombreux et plus gros ont une hypertension précoce, une protéinurie, un nombre de récepteurs AT1 de l’angiotensine augmenté.
Rodriguez et al. ont montré dans l’espèce humaine une réduction du nombre de néphrons chez les grands prématurés. De même, Hughson et al. ont constaté une relation linéaire entre le nombre de glomérules et le poids de naissance des sujets. Hofman et al. ont montré la présence constante d’une résistance à l’insuline chez des enfants de 4 à 10 ans nés prématurés et/ou hypotrophes.
Nous ne détaillerons pas ici tout cet argumentaire, dont une revue générale a été récemment publiée. L’idée générale qui en ressort est que certains individus pourraient naître avec un nombre de néphrons réduit et en hypertrophie compensatrice.
Cette hyperfiltration porterait en elle à la fois le germe de l’hypertension et celui de la glomérulosclérose. Les mécanismes de cette programmation apparaissent complexes et ne sont pas complètement élucidés. Ils pourraient faire intervenir le système rénine-angiotensine foetal, le métabolisme des glucocorticoïdes, et d’autres systèmes encore, au cours de la période de néphrogenèse, correspondant chez l’homme au 3e trimestre de la grossesse.
Obésité, hyperinsulinisme, hyperfiltration :
La description d’une néphropathie liée à l’obésité est relativement récente. Cette néphropathie est pour l’essentiel une hyalinose segmentaire et focale, avec comme particularité des glomérules de grande taille. La fréquence de cette néphropathie serait de l’ordre de 2 % des biopsies rénales, mais elle a décuplé en un peu plus de 10 ans, ce qui fait évoquer la possibilité d’une situation « épidémique » aux États-Unis. La coexistence privilégiée de l’hypertension avec l’obésité, voire le syndrome métabolique au complet, a fait soulever l’hypothèse que cette néphropathie pourrait être partie intégrante de l’ensemble flou de la « néphroangiosclérose ».
Le trait commun à tous les composants du syndrome métabolique est une résistance à l’insuline, et celle-ci est un facteur important d’apparition d’une néphropathie. Chen et al. ont montré, dans une population de 6 400 sujets non diabétiques issus de l’étude NHANES 3, un lien étroit entre l’existence d’une néphropathie (clairance de la créatinine < 60 ml min–1) et le taux plasmatique de l’insuline, le peptide C, l’hémoglobine A1c et le test de résistance à l’insuline. Les mêmes auteurs ont montré un risque relatif de néphropathie de près de 3 chez les sujets porteurs d’un syndrome métabolique, et une corrélation entre ce risque et le nombre de composants du syndrome métabolique présents. Chagnac et al. ont montré que les sujets obèses ont un débit sanguin rénal augmenté par une vasodilatation portant essentiellement sur l’artériole afférente, et une augmentation de la pression glomérulaire. Une augmentation parallèle de la filtration glomérulaire y est associée.
Elle est corrélée avec le degré de résistance à l’insuline. Ces faits semblent indiquer, une fois de plus, le rôle central d’une hyperfiltration et d’une vasodilatation afférente dans la genèse des lésions glomérulaires.
Cette idée n’a pas qu’un intérêt théorique. En effet, une intervention précoce et intensive sur le surpoids devrait être capable de limiter considérablement l’évolutivité de cette néphropathie. Par ailleurs, elle pourrait faire discuter l’intérêt d’un traitement par des agonistes des peroxisome proliferator activated receptors (PPAR), connus pour avoir un effet favorable dans le syndrome métabolique.
Maladie microvasculaire acquise du rein : l’artériole afférente
Les sujets hypertendus ont très souvent des lésions artériolaires, rénales et systémiques, relativement diffuses. Nous avons vu que de telles lésions peuvent parfaitement précéder l’élévation de la PA. Ces lésions ont été largement décrites naguère sous le terme d’artériolosclérose. Ces constatations ont conduit Goldblatt à postuler que de telles lésions pourraient être primitives, et être secondairement responsables de l’hypertension par un mécanisme ischémique puisqu’elles touchent largement les artétioles afférentes. La possibilité de reproduire expérimentalement de telles lésions, et la constatation qu’elles sont suivies de l’apparition d’une hypertension sensible au sel ont redonné une actualité à cette théorie. Le mécanisme par lequel sont créées ces lésions reste cependant assez mystérieux. Il a été évoqué des phénomènes inflammatoires, une infiltration de cellules mononucléées, des pics transitoires de catécholamines générant de brefs à-coups tensionnels. Depuis quelques années, l’acide urique est lui aussi incriminé par le biais d’un effet direct sur la prolifération des cellules musculaires lisses ainsi qu’une dysfonction endothéliale.
Synthèse :
Ces données sont relativement disparates et font référence à des hypothèses multiples. Nous ne chercherons certainement pas à en dresser un schéma uniciste. Et de fait, toutes les hypertensions ne sont pas dépendantes du sel, tous les hypertendus ne sont pas nés hypotrophes ou de mères dénutries, etc.
L’on peut néanmoins constater que tout un faisceau d’arguments converge vers une anomalie de la physiologie rénale, acquise avant la naissance. Cette anomalie peut être soit constitutionnelle et génétique, soit acquise durant la vie intrautérine du fait d’un environnement maternel défavorable, elle comporte en ce cas une oligonéphronie. Dans les deux cas de figure, la situation est caractérisée par une difficulté d’équilibration du bilan sodé. Celle-ci est compensée par une hyperfiltration glomérulaire, soit absolue dans le cas d’une anomalie génétique, soit avec une hypertrophie des néphrons restants.
Cette hyperfiltration est à son tour génératrice, selon le modèle de Brenner, d’une HTA, d’une protéinurie et de lésions glomérulaires de type hyalinose.
Un rôle de l’hyperinsulinisme et du syndrome métabolique a également de forts arguments à son appui. Quand cette situation est-elle « programmée » ? Dès la vie intra-utérine pour certains, lors de la « croissance de rattrapage » des premières années de vie pour d’autres, peut-être plus tard, sous des influences purement ou essentiellement environnementales.
Mais quoi qu’il en soit, dans cette hypothèse, l’individu sera, à l’âge adulte, hypertendu, obèse, porteur d’un syndrome métabolique, et d’une néphropathie que l’on qualifiera de néphroangiosclérose puisqu’elle n’a pas d’autre cause patente que l’hypertension.
Quant aux lésions primitives des artérioles afférentes, elles pourraient s’intégrer dans le même schéma ou bien, s’opposant alors au dogme « brennerien », avoir des mécanismes totalement différents, immunologiques, inflammatoires ou autres. Cette théorie est assurément séduisante, mais attend d’avoir à son appui des arguments plus consistants.
Traitement :
Toute thérapeutique devrait satisfaire à plusieurs impératifs : abaisser la charge de pression certes, mais aussi normaliser l’hémodynamique rénale et en particulier la pression glomérulaire, en respectant l’autorégulation de l’artère afférente. Toutes les données expérimentales et cliniques indiquent que le patient est d’autant plus à risque d’évolution vers l’insuffisance rénale que le débit de protéinurie est important (reflétant probablement le degré du trouble hémodynamique rénal), et corrélativement que l’effet bénéfique du traitement est largement tributaire de la réduction de la protéinurie qu’il entraîne. Aussi ce critère est-il considéré comme absolument essentiel dans le choix d’un médicament chez ces sujets.
Baisse de pression artérielle :
La base du traitement, tant préventif que curatif, est la normalisation de la PA. L’apparition de traitements antihypertenseurs efficaces a fait presque disparaître la néphroangiosclérose maligne et semble avoir fait régresser notablement la néphroangiosclérose bénigne. La relation forte entre le niveau de PA et la probabilité d’une IRT suggère que le maintien d’une normotension peut largement éviter la dégradation de la fonction rénale. Plusieurs études ont considéré les chiffres tensionnels sous traitement pour établir cette relation. Il est plus rare que la réduction de la PA ait été elle-même prise en compte. Dans l’étude de Perry, la réduction de pression était clairement associée à une diminution du risque d’insuffisance rénale.
Hsu a critiqué cette équation avec une certaine virulence.
Il a réalisé une méta-analyse de 10 études prospectives contrôlées de réduction de la PA ayant duré plus de 1 an. Le risque relatif de développer une insuffisance rénale (patients traités versus contrôles) était de 0,97 (0,78-1,21). L’auteur en a conclu que le traitement antihypertenseur n’a aucun effet néphroprotecteur.
Il faut bien admettre que les études prises en compte n’avaient pas été conçues pour tester cette hypothèse, et que l’incidence d’une insuffisance rénale y était très faible, entre 1 pour mille et 2 %. Par exemple, dans l’étude Syst-Eur, sont survenues trois et deux insuffisances rénales pour des effectifs de 2 398 et 2 297 patients. Il y avait donc relativement peu de chances d’observer un effet significatif du traitement, et la puissance statistique ne pouvait être suffisante malgré le grand nombre de patients. Qui plus est, la presque totalité des patients de ces études avait une hypertension très modérée, et les cas sévères en avaient le plus souvent été exclus, ce qui limitait grandement le risque rénal. Les études fondées sur des patients ayant une insuffisance rénale connue avaient été exclues de cette méta-analyse. Or, de telles études ont apporté des résultats allant dans un sens bien différent.
L’étude MDRD a comparé le déclin de la filtration glomérulaire chez 840 patients porteurs de néphropathies diverses (diabétiques sous insuline exclus) pour deux niveaux de PA utilisés comme cible thérapeutique (PAM de 107 et 92 mmHg respectivement pour des sujets de moins de 60 ans). La nature du traitement antihypertenseur prescrit n’était pas contrôlée. Le déclin a été plus rapide chez les patients dont la PA sous traitement était la plus élevée, la relation étant d’autant plus forte si la protéinurie de départ était plus importante.
Le consensus rapporté en 2000 par la National Kidney Fondation (NKF) fait état d’une relation linéaire entre le niveau de PA atteint sous traitement et la perte annuelle de filtration glomérulaire dans neuf études contrôlées, chez des sujets diabétiques ou non. La perte minimale se situe clairement pour un niveau de 98 mmHg de PAM (130/80 mmHg) ou moins. Elle est trois fois plus élevée pour une PAM de 106 mmHg (140/90). Ce travail est l’un des fondements de la recommandation actuelle de pressions basses chez les sujets néphropathes, diabétiques ou non.
Une exception dans cette unanimité est l’étude AASK. Cette étude, très rigoureuse, portait sur 1 094 sujets afroaméricains, porteurs d’une néphroangiosclérose, celle-ci confirmée histologiquement pour un nombre significatif de patients comme nous l’avons dit plus haut. L’étude comportait une comparaison de deux PA cibles, résultant en un groupe qui a atteint 128/78 mmHg et l’autre 141/85 mmHg. Il n’a été observé aucune différence entre ces groupes sur la pente de déclin de la filtration glomérulaire, ni sur le critère composite comportant une perte de 50 % ou plus de filtration glomérulaire, une insuffisance rénale terminale ou le décès. Au demeurant, la protéinurie a été moindre tout au long de l’étude dans le groupe de PA la plus basse.
Toutes les recommandations actuelles indiquent une valeur cible inférieure à 140/90 mmHg dans l’hypertension « toutvenant », plus basse en cas de diabète ou de néphropathie. L’on sait que cette cible n’est pas atteinte chez la majorité des patients, tant s’en faut, de gros efforts de persuasion restent donc nécessaires tant auprès des patients que de leurs médecins. Si l’on admet que l’autorégulation de l’artériole efférente est altérée chez les sujets atteints de néphropathies et chez les diabétiques, la transmission de la pression systémique à la circulation glomérulaire est plus importante chez ces sujets.
C’est la raison pour laquelle la PA doit être abaissée chez eux à des valeurs encore plus basses pour éviter l’aggravation de la néphropathie.
Inhibition du système rénine-angiotensine :
L’idée qu’à baisse égale de la PA, l’inhibition du système rénine-angiotensine par un inhibiteur de l’enzyme de conversion ou par un antagoniste des récepteurs de l’angiotensine II dispose d’un pouvoir néphroprotecteur spécifique a fait couler beaucoup d’encre depuis une dizaine d’années.
Le fondement physiopathologique en est bien établi. L’angiotensine II provoque une vasoconstriction préférentielle de l’artériole efférente. Pour cette raison, elle augmente la pression intraglomérulaire et la fraction de filtration. Cette augmentation est un facteur de sauvegarde de la filtration glomérulaire lors d’une baisse du flux plasmatique rénal, mais elle est aussi, à terme, la source d’une sclérose glomérulaire progressive.
Dans le modèle expérimental de réduction néphronique, l’administration d’un inhibiteur de l’enzyme de conversion réduit de manière spectaculaire la protéinurie et la sclérose glomérulaire, comparativement à tout autre traitement antihypertenseur.
Cette action favorable est le corollaire d’une normalisation de la pression intraglomérulaire.
En clinique, un effet néphroprotecteur spécifique de l’inhibition du système rénine-angiotensine a été montré sans ambiguïté chez les sujets diabétiques, ceux porteurs d’un diabète de type I avec néphropathie, puis ceux porteurs d’un diabète de type II avec une néphropathie, ou une simple microalbuminurie.
L’inhibition du système rénine-angiotensine permet même de prévenir l’apparition de la microalbuminurie. Le concept de protection rénale chez les diabétiques semble donc très solidement établi et ce niveau de preuve a justifié des extensions explicites de l’autorisation de mise sur le marché (AMM) de divers médicaments inhibant le système rénineangiotensine chez les sujets diabétiques avec au moins une microalbuminurie.
Chez les sujets non diabétiques, l’étude AASK a montré une réduction de 36 % du déclin de la filtration glomérulaire et de 48 % du critère de jugement composite (perte de 50 % ou plus de filtration glomérulaire, IRT, ou décès) sous ramipril en comparaison avec l’amlodipine ou le métoprolol, chez les sujets ayant une protéinurie > 300 mg 24 h–1. Sur la cohorte entière (incluant normo- et microalbuminurie), la différence de déclin de la filtration glomérulaire n’était pas significative mais celle de critère de jugement composite l’était. Après ajustement pour diverses covariables, la différence entre ramipril et amlodipine était de 36 % pour le déclin de la filtration glomérulaire et de 38 % pour le critère de jugement composite. Cette étude a donc conclu à un effet bénéfique important d’un IEC comparé à d’autres classes de médicaments chez les sujets afro-américains porteurs d’une néphroangiosclérose.
L’étude REIN a de même montré que des sujets atteints de néphropathie chronique avec protéinurie étaient mieux protégés par un inhibiteur de l’enzyme de conversion contre l’apparition d’une insuffisance rénale terminale qu’ils ne l’étaient par un traitement dit conventionnel.
Une méta-analyse de 11 essais contrôlés chez des sujets néphropathes et non diabétiques a montré un bénéfice substantiel des inhibiteurs de l’enzyme de conversion. Sous ce traitement, après ajustement pour la PA, le risque relatif d’IRT était de 0,69 (0,51-0,94) et celui de doublement de la créatinine de 0,70 (0,55-0,90). Cet effet était d’autant plus marqué que la protéinurie était abondante et devenait très faible pour des protéinuries inférieures à 0,5 g 24 h–1.
Afin d’obtenir une inhibition plus complète du système rénine-angiotensine, l’association d’un inhibiteur de l’enzyme de conversion avec un antagoniste des récepteurs de l’angiotensine a été recommandée depuis une dizaine d’années. Une telle association permet en effet d’obtenir une meilleure réduction de la protéinurie, et probablement une meilleure préservation de la fonction rénale. La principale étude clinique en faveur d’une telle hypothèse est COOPERATE. Dans cette étude, 336 patients ont été recrutés, tous porteurs d’une néphropathie non diabétique, et 263 ont été retenus après une période de « run in » de 18 semaines. Ils ont reçu par tirage au sort soit du losartan, soit du trandolapril, soit l’association des deux. Le risque relatif d’atteindre le critère de jugement principal (doublement de la créatinine ou insuffisance rénale terminale) chez les patients recevant l’association a été de 0,38 par rapport au trandolapril seul ou de 0,40 par rapport au losartan seul.
Face à cet argumentaire très complet, voire idyllique, il est néanmoins une voix fortement discordante. Bidani et Griffin, dans une série de travaux, se sont employés à montrer que la néphroprotection par inhibition du système rénine-angiotensine est en réalité totalement dépendante du niveau de PA atteint, que ce soit dans les études cliniques ou en expérimentation animale. Leur argumentation se fonde surtout sur les données de la MAPA pour les études cliniques et celles des enregistrements permanents pour les études expérimentales.
Ils sont néanmoins restés assez isolés dans cette position, et leur argumentation ne parvient pas à être définitivement convaincante.
D’autres auteurs ont suggéré que les médicaments inhibant le système rénine-angiotensine auraient un effet plus marqué sur la pression artérielle centrale que sur celle de l’artère humérale, contrairement par exemple aux b-bloquants. Cette différence pourrait expliquer la néphroprotection liée à ces thérapeutiques par un effet non pas « au-delà de la pression artérielle » mais simplement « au-delà de l’artère humérale ».
Antialdostérone :
Des arguments, surtout expérimentaux, indiquent :
• que l’aldostérone joue probablement un rôle sous-estimé dans la fibrogenèse rénale ;
• que l’usage d’un IEC ne limite l’aldostérone que très transitoirement, un effet d’« échappement » intervenant après quelques jours ou semaines.
Les antialdostérone, spironolactone et éplerenone, ont fait preuve d’un effet favorable sur la protéinurie et sur la fibrogenèse rénale, chez le rat SHRSP, et dans le modèle de réduction néphronique.
L’argumentation pour un effet néphroprotecteur des antialdostérones en clinique repose essentiellement sur cette base théorique, les études restant rares. Chrysostomou et al. ont étudié huit patients gardant sous énalapril une protéinurie supérieure à 1 g 24 h–1. Chez ces patients, l’adjonction de spironolactone a abaissé la protéinurie de 3,81 ± 2,5 à 1,75 ± 1,02. De même, Sato et al. ont montré un abaissement supplémentaire de la protéinurie par l’adjonction de spironolactone chez 13 patients diabétiques en « échappement de l’aldostérone » à un IEC. Dans leur recommandation, Wilmer et al. considèrent l’usage des antialdostérones comme assorti d’un niveau de preuve 2.
Un rappel à la prudence est cependant nécessaire. Aussi bien les IEC, les antagonistes des récepteurs de l’angiotensine, et les antialdostérones augmentent tous la kaliémie. Les mélanges ne sont donc pas forcément anodins ni dénués de risques, et la kaliémie doit être bien surveillée chez ces patients, dont la fonction rénale déjà altérée augmente encore le risque. Rappelons que la publication de l’étude RALES a été suivie d’une forte augmentation des accidents d’hyperkaliémie.
Inhibiteurs calciques :
Nous l’avons évoqué plus haut, les inhibiteurs calciques semblent peu favorables à la fonction rénale du fait qu’ils abolissent peu ou prou l’autorégulation du tonus de l’artériole afférente et favorisent donc la transmission de la pression systémique à la circulation glomérulaire. Si la cause paraît entendue en expérimentation animale, les données humaines sont plus fragiles. Théoriquement, ces médicaments seraient délétères pour la fonction rénale, du moins si le contrôle de la PA est imparfait, du fait de cette transmission de la pression systémique. Cet effet semble plus marqué pour les dihydropyridines que pour les autres bloqueurs calciques (ces derniers pourraient même avoir un effet antiprotéinurique selon certaines études). Enfin l’homogénéité de la classe des dihydropyridines à cet égard n’est probablement pas absolue.
Diverses études indiquent que les dihydropyridines réduisent moins la microalbuminurie qu’un IEC. Ruggenenti et al., dans une étude ancillaire de REIN, ont identifié les patients ayant reçu un inhibiteur calcique. Ces derniers ont gardé, tout au long de l’étude, une protéinurie supérieure aux autres, sauf s’ils recevaient également l’IEC et/ou si la PAM sous traitement était inférieure à 100 mmHg, ce qui valide assez bien l’hypothèse théorique. Dans l’étude IDNT, l’amlodipine n’a pas réduit la protéinurie ni amélioré le pronostic rénal, contrairement à l’irbesartan. De même dans l’étude AASK l’amlodipine n’a pas réduit la protéinurie, contrairement au ramipril.
L’amlodipine a induit une augmentation transitoire de la filtration glomérulaire, mais celle-ci a disparu avec le temps, faisant place à un meilleur effet protecteur du ramipril.
En revanche, les inhibiteurs calciques semblent n’avoir aucun effet négatif lorsqu’ils sont associés à un inhibiteur de l’enzyme de conversion ou à un antagoniste des récepteurs de l’angiotensine.
Par exemple, dans l’étude RENAAL, le pronostic rénal n’a pas été différent chez les patients recevant ou non un inhibiteur calcique, le bénéfice apporté par le losartan n’en étant pas modifié. Il indique clairement que :
• une dihydropyridine est supérieure à un placebo, du fait de la baisse de PA (Syst-Eur) ;
• une dihydropyridine est inférieure à un IEC (AASK) ;
• une association dihydropyridine et IEC est équivalente à l’IEC seul (Nephros), et supérieure à la dihydropyridine seule (REIN).
En définitive, si les inhibiteurs calciques ne semblent pas partager l’effet bénéfique d’autres classes (effet néphroprotecteur indépendant de la pression), il n’y a pas d’étude solide indiquant qu’ils sont susceptibles d’avoir un effet néfaste à moyen ou long terme sur la fonction rénale. Aussi la plupart des auteurs s’accordent-ils à ne pas recommander l’usage d’un inhibiteur calcique en première intention ou en monothérapie chez les patients porteurs d’une atteinte rénale. En revanche, il n’est mis aucune restriction à l’usage de ces médicaments en association avec un antihypertenseur inhibant le système rénine-angiotensine, ou dans le cadre d’une plurithérapie, et l’on sait que celle-ci est très souvent nécessaire pour atteindre la cible de PA chez ces patients.
Conclusion :
La néphroangiosclérose est classiquement la conséquence à long terme d’une hypertension et se traduit par un tableau d’insuffisance rénale chronique progressive. Cette constatation est relativement fréquente chez les sujets noirs américains souffrant d’hypertension sévère, elle est excessivement rare chez les sujets caucasiens et/ou avec hypertension modérée. Tant les données cliniques qu’expérimentales indiquent que la PA peut effectivement avoir des conséquences directes sur la physiologie et l’anatomie rénales. En revanche, les inégalités ethniques et la mauvaise corrélation avec les chiffres de PA indiquent que la relation n’est pas aussi simple, et que nombre d’autres facteurs sont impliqués dans la genèse de cette néphropathie.
Le concept lui-même de néphroangiosclérose a été remis en cause, au profit de celui d’une néphropathie congénitale, d’origine multifactorielle, qui serait source tout à la fois de l’hypertension et des lésions rénales évolutives ultérieures. Les mécanismes de la genèse de cette néphropathie durant la vie intra-utérine font l’objet d’études intensives.
La réalité n’est probablement pas aussi manichéenne et d’importants progrès restent à accomplir pour mieux cerner la nature de cette néphropathie associée à l’hypertension. Quoi qu’il en soit, il est au moins très clair que PA et lésions rénales sont engagées dans une boucle d’autoaggravation. En pratique, le traitement peut – et doit – rompre ce cercle vicieux. Cette rupture commence par un contrôle optimal de la PA. À ce regard, que la lésion rénale soit initialement conséquence de la pression mécanique ou au contraire qu’elle l’ait engendrée, ne change pas fondamentalement l’attitude thérapeutique. Certains antihypertenseurs, en particulier ceux qui inhibent le système rénine-angiotensine, semblent doués d’un pouvoir néphroprotecteur supplémentaire, au-delà de la baisse de pression. Leur usage rationnel, le plus souvent dans le cadre d’une plurithérapie, devrait permettre de réduire encore la fréquence de l’insuffisance rénale chez les hypertendus, surtout dans les populations exposées.